
Wetenschap
Welke delen van het calciumchloride worden aangetrokken door welk watermolecuul?
calciumionen (ca²⁺):
* aantrekkingskracht op zuurstof: De positief geladen calciumionen (Ca²⁺) worden sterk aangetrokken tot de negatief geladen zuurstofatomen in watermoleculen (H₂O). Dit komt door elektrostatische aantrekkingskracht, waar tegengestelde ladingen aantrekken.
chloride -ionen (Cl⁻):
* aantrekkingskracht op waterstof: De negatief geladen chloride -ionen (CL⁻) worden aangetrokken tot de positief geladen waterstofatomen in watermoleculen (H₂O). Nogmaals, dit komt door elektrostatische aantrekkingskracht.
Over het algemeen:
* Het calciumchloride lost op in water omdat de sterke elektrostatische attracties tussen de ionen en de watermoleculen de ionische bindingen overwinnen die de CaCl₂ -verbinding tegen elkaar houden.
* Dit oplossende proces wordt hydratatie genoemd en de watermoleculen omringen de ionen en vormen een hydratatieschaal.
Visualisatie van de interactie:
Stel je de watermoleculen voor als kleine magneten. Het zuurstofuiteinde van elk watermolecuul heeft een enigszins negatieve lading, terwijl het waterstofuiteinde een enigszins positieve lading heeft.
* De calciumionen (positief) worden aangetrokken door de zuurstofuiteinden (negatief) van de watermoleculen.
* De chloride -ionen (negatief) worden aangetrokken door de waterstofuiteinden (positief) van de watermoleculen.
Deze sterke interactie zorgt ervoor dat het calciumchloride uit elkaar brak en oplost in het water.
 Zijn water- en waterstofperoxide -allotropen?
Zijn water- en waterstofperoxide -allotropen?  Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen
Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen Wat zijn producten gemaakt van fossiele brandstoffen?
Wat zijn producten gemaakt van fossiele brandstoffen?  Wat zijn 5 stoffen die in water zinken?
Wat zijn 5 stoffen die in water zinken?  Hoe gaan opgeloste moleculen door het membraan?
Hoe gaan opgeloste moleculen door het membraan?
 Het gebied van de Grote Meren toekomstbestendig maken door klimaatonderzoek
Het gebied van de Grote Meren toekomstbestendig maken door klimaatonderzoek Ter ere van gletsjers, die draken van ijs bekeken met zorg en fascinatie
Ter ere van gletsjers, die draken van ijs bekeken met zorg en fascinatie Boomringen duiden de uitbarsting van de IJslandse vulkaan aan tot een halve eeuw voor menselijke bewoning
Boomringen duiden de uitbarsting van de IJslandse vulkaan aan tot een halve eeuw voor menselijke bewoning Kijken naar Katla:IJslanders plannen voor volgende vulkaanuitbarsting
Kijken naar Katla:IJslanders plannen voor volgende vulkaanuitbarsting Het terugdringen van de uitstoot van steden heeft economische voordelen - en die wegen uiteindelijk op tegen de kosten
Het terugdringen van de uitstoot van steden heeft economische voordelen - en die wegen uiteindelijk op tegen de kosten
Hoofdlijnen
- Hoe is deze uitspraak allemaal op één en dezelfde manier van toepassing op grote meercellige organismen?
- Wetenschappers leren hoe ze een wegversperring kunnen vermijden bij het herprogrammeren van cellen
- Vermindert intensieve landbouw de reproductie van rouwduiven in het oosten van de VS?
- Hoe kan biotechnologie de opwarming van de aarde stoppen?
- Produceren vleesetende planten voedsel door fotosynthese?
- Wat is carbolfuchsin?
- Met uitsterven bedreigde mus in Centraal-Florida die in het wild waarschijnlijk niet zal overleven
- Wat belangrijk is bij het maken van melk:Uit onderzoek blijkt dat foetale seks de melkproductie kan beïnvloeden
- Waarom zijn mensen hun staart kwijtgeraakt?
- Een nieuwe bètavoltaïsche technologie met kleurstoffen voor een betere energieproductie

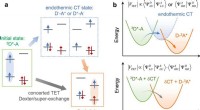
- Endotherme ladingsoverdracht bemiddelt ondiepe afstandsafhankelijke triplet-energiemigratie
- Video:Werken anti-rimpelcrèmes?

- Onderzoekers 3D printen eerste hoogwaardige nanogestructureerde legering die zowel ultrasterk als ductiel is

- Cellulaire stress verdediging
 Wat is de waarde als de aarde stopt met draaien?
Wat is de waarde als de aarde stopt met draaien?  Indonesische aardbeving en tsunami verwoesten kust, veel slachtoffers
Indonesische aardbeving en tsunami verwoesten kust, veel slachtoffers Nieuwe NASA-animaties tonen de enorme neerslagtotalen van de Filippijnse tropische cyclonen van 2013
Nieuwe NASA-animaties tonen de enorme neerslagtotalen van de Filippijnse tropische cyclonen van 2013  Nano dit, dat, wat de...
Nano dit, dat, wat de...  Huawei ontkent Amerikaanse beschuldigingen van technologiediefstal
Huawei ontkent Amerikaanse beschuldigingen van technologiediefstal Wat zijn koolstofdioxide water en lichte energie veranderd tijdens fotosynthese?
Wat zijn koolstofdioxide water en lichte energie veranderd tijdens fotosynthese?  Enorme lichtgevende nevel vormt een kosmisch mysterie
Enorme lichtgevende nevel vormt een kosmisch mysterie Hoe beïnvloedt de omgeving de manier waarop u leeft?
Hoe beïnvloedt de omgeving de manier waarop u leeft?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

