
Wetenschap
Hoeveel valentie -elektronen zijn er in een fluoratoom, zullen atomen vormen bindingen verklaren?
* valentie -elektronen in fluor: Fluor heeft 7 valentie -elektronen .
* Waarom atomen bindingen vormen: Atomen vormen bindingen om een stabiele elektronenconfiguratie te bereiken, die idealiter lijkt op de elektronenconfiguratie van een edelgas. Nobele gassen zijn zeer niet -reactief omdat ze een volledige buitenste schaal van elektronen hebben, waardoor ze zeer stabiel zijn.
* fluor's bindingsgedrag: Fluor, met 7 valentie -elektronen, is slechts één elektron weg van het hebben van een volledige buitenste schaal (zoals Neon, die 8 heeft). Daarom heeft fluor de neiging om één elektron te krijgen om zijn buitenste schaal te voltooien. Daarom is het zeer reactief en vormt het gemakkelijk bindingen.
* soorten obligaties: Fluor vormt typisch ionische bindingen met metalen, waar het een elektron van het metaalatoom krijgt. Het vormt ook covalente obligaties met niet -metalen, waarbij het elektronen deelt om een volledige buitenste schaal te bereiken.
Samenvattend: De hoge reactiviteit van fluor wordt aangedreven door de behoefte om één elektron te krijgen om een stabiele octetconfiguratie te bereiken. Dit leidt tot de vorming van bindingen met andere atomen.
 Ontgrendel de kracht van citrien Betekenis:genezende eigenschappen en toepassingen
Ontgrendel de kracht van citrien Betekenis:genezende eigenschappen en toepassingen  Hoe houden bomen de lucht schoon?
Hoe houden bomen de lucht schoon?  Onderzoekers duiken diep in hoeveel water er in sneeuw is opgeslagen
Onderzoekers duiken diep in hoeveel water er in sneeuw is opgeslagen  Hoe een autoclaaf spore-testen
Hoe een autoclaaf spore-testen  Onderzoek toont aan hoe klimaat voedselwebben beïnvloedt, vormt een sociaaleconomische bedreiging in Oost-Afrika
Onderzoek toont aan hoe klimaat voedselwebben beïnvloedt, vormt een sociaaleconomische bedreiging in Oost-Afrika
Hoofdlijnen
- Duivenvoetveergenen geïdentificeerd:onderzoek wijst uit hoe geschubde dinosauruspoten vogelachtige veren kunnen krijgen
- Wat is het directe resultaat van aerobe ademhaling?
- Welk type weefsellijnen de nasopharynx?
- Kunnen celstructuren worden gezien onder lichtmicroscopen?
- Wanneer treedt acidose op?
- Wat beschrijft waarom het fossiele record voor ongewervelde dieren fragmentarisch is?
- Hoe elektrische vissen elektrische orgels konden ontwikkelen
- Welke bacteriën dragen mensen?
- Wetenschappers weten dat organismen nauwer verwant zijn, zullen DNA -sequenties hebben die vergelijkbaar zijn met elkaar dan de verre welke twee hieronder waarschijnlijk H?
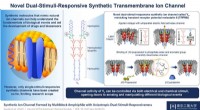
- Dubbel genot:nieuw synthetisch transmembraan-ionkanaal kan op twee manieren worden geactiveerd
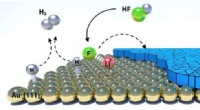
- Batterijen verborgen laag onthuld
- Moleculaire dynamische simulatie werpt nieuw licht op de vorming van methaanhydraat

- Bakstenen bouwen van plastic afval

- Wat is het verschil tussen relatieve vochtigheid en dauwpunt?

 Hoe wordt binnenlandse elektriciteit gemeten?
Hoe wordt binnenlandse elektriciteit gemeten?  Warme wind doet ook in de winter sneeuw smelten op Antarctica
Warme wind doet ook in de winter sneeuw smelten op Antarctica Zachte apparaten, aangedreven door gestresste algen, gloeien in het donker wanneer ze worden geplet of uitgerekt
Zachte apparaten, aangedreven door gestresste algen, gloeien in het donker wanneer ze worden geplet of uitgerekt Vrouwelijke wetenschappers die de wereld veranderden
Vrouwelijke wetenschappers die de wereld veranderden Wanneer zijn zonnecellen het meest efficiënt?
Wanneer zijn zonnecellen het meest efficiënt?  Waar komt slechte lucht vandaan?
Waar komt slechte lucht vandaan? Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen
Studie:Diepzeewezens die een feest of hongersnood leven vanwege energiestromen Wat zijn de twee soorten magma en wat maakt ze verschillend?
Wat zijn de twee soorten magma en wat maakt ze verschillend?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

