Wetenschap
Dubbel genot:nieuw synthetisch transmembraan-ionkanaal kan op twee manieren worden geactiveerd
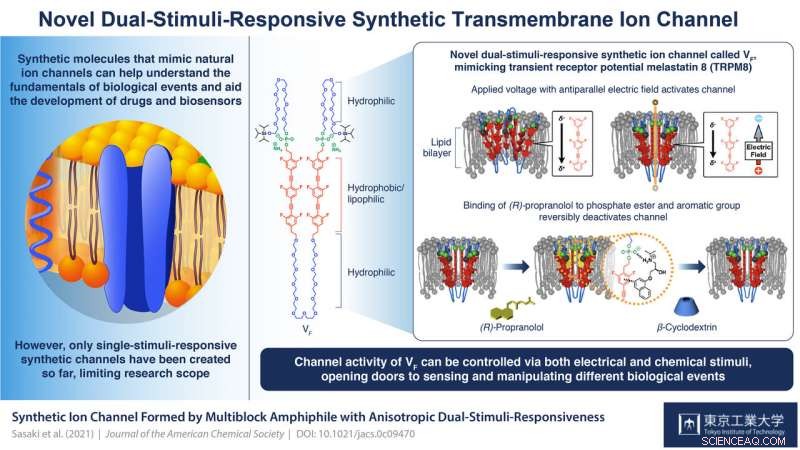
Een multiblock amfifiele VF werd ontwikkeld. Toen VF werd opgenomen in de lipide dubbellaagmembranen, VF vormde een supramoleculaire ionkanaal. De ionentransporteigenschap van VF kan omkeerbaar worden veranderd door toevoeging van (R)-propranolol, een aromatisch amine dat bekend staat als een antiaritmisch middel, gevolgd door de toevoeging van β-cyclodextrine voor de verwijdering ervan. Krediet:Tokyo Tech
Wetenschappers van het Tokyo Institute of Technology (Tokyo Tech) en de Universiteit van Tokyo, Japan, hebben, Voor de eerste keer, synthetiseerde een nieuw kunstmatig transmembraan-ionkanaal gemodelleerd naar een natuurlijk gevonden transmembraankanaal dat betrokken is bij neuronsignalering - dat reageert op zowel chemische als elektrische stimuli. Gezien zijn algemene eigenschappen, dit kunstmatige kanaal opent deuren naar nieuw fundamenteel onderzoek naar cellulair transport en signalering, nieuwe mogelijkheden in de ontwikkeling van geneesmiddelen, en het potentieel voor nieuwe soorten biosensoren.
Een belangrijke rode draad die de delicate balans van een complex biologisch systeem bij elkaar houdt, is het transmembraan-ionkanaal. Dit zijn supramoleculaire, of meerdere moleculen, ionen- en molecuuluitwisselingsroutes ingebed in celmembranen om essentieel chemisch transport van en naar de cel te verzekeren en celsignalering te vergemakkelijken.
In recente jaren, synthetische biomoleculen die de structuren en functies van natuurlijke ionenkanalen nabootsen, hebben veel belangstelling gewekt bij moleculaire biologieonderzoekers als modellen voor het bestuderen van de fundamenten van deze kanalen en misschien, zelfs het creëren van alternatieve geneesmiddelen of het ontwikkelen van geavanceerde biosensoren.
Echter, hoewel er verschillende goede synthetische ionenkanalen zijn ontwikkeld, de meeste worden geactiveerd via slechts een enkele stimulus en geen enkele is wat wetenschappers "anisotrope dual-stimuli-responsive, " of die kunnen worden geactiveerd en gecontroleerd door twee specifieke soorten stimuli, afhankelijk van de bevooroordeelde oriëntatie van de structuur in het membraan. Dit heeft een beperkte onderzoeksruimte in het veld.
Nutsvoorzieningen, Tenslotte, een groep wetenschappers van Tokyo Tech en de Universiteit van Tokyo, Japan, hebben met succes een biomolecuul gesynthetiseerd dat lijkt op een natuurlijk anisotroop dual-stimuli-responsief kanaal:transient receptor potential melastatine 8 (TRPM8), die ten grondslag ligt aan signaaloverdracht in neuronen. Hun kanaal heet VF en hun doorbraak is gepubliceerd in Tijdschrift van de American Chemical Society .
VF is een multiblock amfifiele (het heeft zowel waterminnende (hydrofiele) als vetminnende (lipofiele) eigenschappen) molecuul dat kan worden samengevoegd om supramoleculaire kanalen te vormen. Elke eenheid in een blok omvat een organische lipofiele/hydrofobe groep met zes fluoride-atomen die het in de lipidedubbellaag van het celmembraan plaatsen en het een elektrische polariteit verlenen; een fosfaatestergroep die ervoor zorgt dat de structuur vooringenomen is in zijn oriëntatie (met de fosfaatzijde naar de extracellulaire ruimte); en flexibele ethyleenglycol hydrofiele ketens tussen hydrofobe eenheden en aan de uiteinden die bijdragen aan de responsiviteit van stimuli.
De studies van de wetenschappers van deze structuur toonden aan dat door de polariteiten en amplitudes van aangelegde spanningen te manipuleren, het kanaal kan worden geactiveerd. Prof. Kazushi Kinbara, hoofdwetenschapper in het team, legt uit:"Zonder het aanleggen van een spanning, de hydrofobe eenheden van VF stoten elkaar af zodat ze ruimtelijk van elkaar zouden worden gescheiden en geen heldere en functionele transmembraan-ionkanalen zouden vormen. Wanneer een spanning met de elektrische veldvector antiparallel aan de elektrische polariteit van de VF wordt aangelegd, een verplaatsing van elektronenverdeling binnen VF optreedt, het verzwakken van de afstoting tussen hydrofobe eenheden en het verbeteren van hun face-to-face stapeling. Dit veroorzaakt conformationele veranderingen door het hele molecuul, wat leidt tot de vorming van supramoleculaire kanalen die efficiënt ionen door het membraan kunnen transporteren."
De wetenschappers ontdekten dat de tweede stimulus te maken had met de binding van ligand (R)-propranolol op de verbinding tussen de fosfaatesters en de hydrofobe eenheden. Zoals prof. Kinbara uitlegt, "(R)-propranolol is een anti-aritmisch middel waarvan bekend is dat het spanningsafhankelijke natriumkanalen blokkeert. onze eerdere studies gaven aan dat het interageert met fosfaatestergroepen en aromatische eenheden om zich in de kanaalporie te lokaliseren en ionentransport te blokkeren. Dat is waarom we het voor onze studie hebben gekozen." Hun nucleaire magnetische resonantiespectroscopie onthulde de binding ervan op de fosfaatlocaties, en dat het de stroom en dus de ionkanaalactiviteit van VF volledig remt. De verwijdering ervan via de toevoeging van β-cyclodextrine activeert het kanaal opnieuw. "Omkeerbare ligandbinding zoals deze is de sleutel tot het handhaven van de homeostase in het lichaam via de regulatie van transmembraan-ionkanalen. De sterk gereguleerde oriëntatie van VF maakte deze anisotrope respons op dit ligandmolecuul mogelijk, " zegt prof. Kinbara. "Met ons succes in deze studie, er is nu een groot potentieel voor het waarnemen en manipuleren van verschillende biologisch belangrijke gebeurtenissen."
Inderdaad, met de synthese van VF, geschikt voor de variabele cellulaire omgevingen die alomtegenwoordig zijn in biologische systemen, misschien, nieuwe mogelijkheden voor onderzoek ontstaan op het gebied van moleculaire biologie.
 Een op rhodium gebaseerde katalysator voor het maken van organosilicium met minder edelmetaal
Een op rhodium gebaseerde katalysator voor het maken van organosilicium met minder edelmetaal Afdrukbaar, kleurrijke camouflage met polymeren
Afdrukbaar, kleurrijke camouflage met polymeren Wetenschappers ontwikkelen real-time techniek voor het bestuderen van ionische vloeistoffen op elektrode-interfaces
Wetenschappers ontwikkelen real-time techniek voor het bestuderen van ionische vloeistoffen op elektrode-interfaces Duurzamere geuren creëren met biotech
Duurzamere geuren creëren met biotech Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
 Wat gebeurt er als de luchtdruk en temperatuur dalen?
Wat gebeurt er als de luchtdruk en temperatuur dalen?  Draait de aarde langzamer of sneller aan de bovenkant?
Draait de aarde langzamer of sneller aan de bovenkant?  Nederlandse klimaatwetenschapper Geert Jan van Oldenborgh op 59-jarige leeftijd overleden
Nederlandse klimaatwetenschapper Geert Jan van Oldenborgh op 59-jarige leeftijd overleden Tropische storm Ophelia verschijnt als een komma in NASA-beelden
Tropische storm Ophelia verschijnt als een komma in NASA-beelden De wereld van kunststoffen, in cijfers
De wereld van kunststoffen, in cijfers
Hoofdlijnen
- Ondanks bosverlies, een beschermd Afrikaans gebied heeft nog steeds potentieel om tienduizenden olifanten te ondersteunen, 1K leeuwen
- De belangrijkste componenten van het skeletsysteem
- Geneesmiddelresistentie uit schimmels verdrijven
- Arbusculaire mycorrhiza-schimmelgemeenschappen blootgesteld met nieuwe benadering van DNA-sequencing
- Verouderd DNA kan genen anders activeren
- Een enzym dat de vorming van het DNA katalyseert Molecuul
- De reden voor het kleuren van een exemplaar op de microscoop
- Vetmolecuul in menselijk bloed controleert malariaparasieten beslissing om op muggen te springen
- Symbiose en celevolutie:Lynn Margulis en de oorsprong van eukaryoten
 Wat zit er achter het vreemde weer in Kenia?
Wat zit er achter het vreemde weer in Kenia? Moleculen vormen 2D-patronen die nog nooit eerder zijn waargenomen:experimenten produceren ongrijpbare 5-vertex-tegels
Moleculen vormen 2D-patronen die nog nooit eerder zijn waargenomen:experimenten produceren ongrijpbare 5-vertex-tegels How Do Birds Find Bird Feeders?
How Do Birds Find Bird Feeders?  LAMOST-Kepler/K2 survey maakt het eerste lichtresultaat bekend
LAMOST-Kepler/K2 survey maakt het eerste lichtresultaat bekend 3D-printers openen nieuwe ontwerpruimte voor draadloze apparaten
3D-printers openen nieuwe ontwerpruimte voor draadloze apparaten Onderzoekers ontdekken dat door mensen veroorzaakte vervuiling de omgeving zelfs ondergronds verandert
Onderzoekers ontdekken dat door mensen veroorzaakte vervuiling de omgeving zelfs ondergronds verandert Dikke rookwolken op de stranden van Zuid-Portugal terwijl branden woeden
Dikke rookwolken op de stranden van Zuid-Portugal terwijl branden woeden De Australian Square Kilometre Array Pathfinder bereikt eindelijk de big-data-snelweg
De Australian Square Kilometre Array Pathfinder bereikt eindelijk de big-data-snelweg
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com