
Wetenschap
Boor trichloride is gas maar stikstofvloeistof waarom?
Hier is een uitsplitsing:
boor trichloride (Bcl 3 ):
* Structuur: Bcl 3 Heeft een trigonale vlakke structuur met boor in het midden en drie chlooratomen eromheen.
* polariteit: De B-CL-bindingen zijn polair vanwege het elektronegativiteitsverschil tussen boor en chloor. Het molecuul zelf is echter niet -polair omdat de individuele binddipolen elkaar annuleren.
* intermoleculaire krachten: De enige significante intermoleculaire krachten aanwezig in Bcl 3 zijn London dispersiekrachten (ook bekend als van der Waals Forces), die zwak zijn.
stikstof (n 2 ):
* Structuur: N 2 is een diatomee molecuul met een drievoudige binding tussen de stikstofatomen.
* polariteit: De N≡N -binding is niet -polair omdat de elektronegativiteit van beide stikstofatomen hetzelfde is.
* intermoleculaire krachten: Terwijl n 2 is niet -polair, het heeft sterkere dispersiekrachten in Londen dan bcl 3 . Dit komt door de grotere elektronwolk rond het stikstofmolecuul, wat leidt tot grotere tijdelijke dipolen.
Belangrijkste verschillen:
* Sterkte van intermoleculaire krachten: Stikstof heeft sterkere dispersietroepen in Londen dan boortrichloride vanwege zijn grotere elektronenwolk en drievoudige binding.
* Molecuulgewicht: Stikstof (n 2 ) heeft een hoger molecuulgewicht dan boortrichloride (Bcl 3 ), wat ook bijdraagt aan sterkere dispersiekrachten in Londen.
Deze sterkere intermoleculaire krachten in stikstof zijn de belangrijkste reden waarom het bestaat als een vloeistof bij kamertemperatuur, terwijl boortrichloride een gas is.
 NASA onderzoekt orkaanschade aan de bossen van Puerto Rico
NASA onderzoekt orkaanschade aan de bossen van Puerto Rico Het onrecht dat onderwijs het milieu aandoet:een verhaal van een overlevende
Het onrecht dat onderwijs het milieu aandoet:een verhaal van een overlevende Studie onthult dreiging van catastrofale supervulkaanuitbarstingen die altijd aanwezig zijn
Studie onthult dreiging van catastrofale supervulkaanuitbarstingen die altijd aanwezig zijn Na tientallen jaren van brandbestrijding, Amerikaanse bossen waren klaar om te verbranden, specialist zegt
Na tientallen jaren van brandbestrijding, Amerikaanse bossen waren klaar om te verbranden, specialist zegt Welk deel van een plant brengt waterbloemsteelwortels of bladeren?
Welk deel van een plant brengt waterbloemsteelwortels of bladeren?
Hoofdlijnen
- Een litteken of geen litteken bij het weerstaan van lintwormen:dat is de (evolutionaire) vraag
- Noem de structuur die sensorisch ganglion is van elke dorsale wortel?
- Human Heart Science Projects
- Hoe dicht is een cel? Onderzoekers hebben een manier bedacht om die vraag te beantwoorden
- Oude uitwerpselen onthullen hoe 'moerasdieet' de Vennen uit de Bronstijd met parasieten besmette
- DNA in dunne draadachtige vorm wordt aangeroepen?
- Hebben rivieren de evolutie van Sumatraanse cascadekikkers beïnvloed?
- Ecologen gebruiken de nieuwste tandheelkundige scantechnologie om jong koraal te bestuderen
- Hoe bloemen zich aanpassen aan hun bestuivers
- Onderzoekers ontwikkelen nieuwe techniek voor productie van plasmonische apparaten

- ARS Cotton Advance helpt bij het lanceren van wondverband

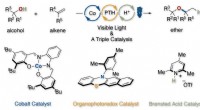
- Ontwikkeling van een nieuwe methode voor het synthetiseren van dialkylethers met behulp van drie katalysatoren die alkenen hydroxyleren
- Je volgende houten stoel kan plat aankomen en dan drogen in een 3D-vorm

- Hoe sensoren op de huid te plakken zonder lijm?
 Wat zijn drie manieren waarop wetenschappers hun ideeën delen?
Wat zijn drie manieren waarop wetenschappers hun ideeën delen?  Als je alle krachten op een object bij elkaar toevoegt en een niet-nulwaarde krijgt die deze wordt genoemd?
Als je alle krachten op een object bij elkaar toevoegt en een niet-nulwaarde krijgt die deze wordt genoemd?  Welke energie produceert zonnen warmte en licht?
Welke energie produceert zonnen warmte en licht?  Waar is kwarts?
Waar is kwarts?  Welke term verwijst naar het product van de massa en snelheid van een objecten?
Welke term verwijst naar het product van de massa en snelheid van een objecten?  Chemische formule voor kalium en chloor?
Chemische formule voor kalium en chloor?  Een zeer groot organisch molecuul dat bestaat uit ketens kleinere moleculen wordt genoemd?
Een zeer groot organisch molecuul dat bestaat uit ketens kleinere moleculen wordt genoemd?  Wetenschap en wetenschappers hoog aangeschreven over de hele wereld:enquête
Wetenschap en wetenschappers hoog aangeschreven over de hele wereld:enquête
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

