
Wetenschap
Hoe verschillen de smeltpunten van ionische verbindingen van moleculaire verbindingen?
ionische verbindingen
* Hoge smeltpunten: Ionische verbindingen hebben over het algemeen zeer hoge smeltpunten (vaak boven 300 ° C).
* Sterke elektrostatische attracties: De sterke elektrostatische attracties tussen tegengesteld geladen ionen (ionische bindingen) vereisen een aanzienlijke hoeveelheid energie om te overwinnen.
* kristallijne structuur: Ionische verbindingen vormen een rigide, kristallijne roosterstructuur waar ionen strak worden verpakt. Deze structuur versterkt de interionische krachten verder.
moleculaire verbindingen
* Lagere smeltpunten: Moleculaire verbindingen hebben typisch veel lagere smeltpunten in vergelijking met ionische verbindingen.
* Zwakkere intermoleculaire krachten: De krachten die moleculen tegen elkaar houden (zoals waterstofbindingen, dipool-dipoolinteracties en Londense dispersiekrachten) zijn zwakker dan ionische bindingen. Deze krachten zijn gemakkelijker te overwinnen, wat resulteert in lagere smeltpunten.
* variabele structuren: Moleculaire verbindingen hebben verschillende structuren, van eenvoudige lineaire vormen tot complexe driedimensionale vormen. Deze structurele variabiliteit kan hun smeltpunten beïnvloeden.
Belangrijkste verschillen in een notendop:
* bindingssterkte: Ionische bindingen zijn veel sterker dan de intermoleculaire krachten die worden gevonden in moleculaire verbindingen.
* roosterstructuur: Ionische verbindingen hebben een sterke, rigide roosterstructuur, terwijl moleculaire verbindingen meer gevarieerde en minder rigide structuren hebben.
Voorbeelden:
* ionisch: Natriumchloride (NaCl), dat een smeltpunt van 801 ° C heeft.
* moleculair: Water (H₂o), dat een smeltpunt van 0 ° C heeft.
Uitzonderingen:
Hoewel de algemene trends waar zijn, zijn er uitzonderingen. Sommige moleculaire verbindingen, zoals diamant (een netwerkcovalente vaste stof), hebben extreem hoge smeltpunten vanwege de sterke covalente bindingen in hun structuren.
 Moessonregens overspoelen Filippijnse dorpen, duizenden evacueren
Moessonregens overspoelen Filippijnse dorpen, duizenden evacueren Marine krijgt concurrentievoordeel met onderzoek naar biologische oceaanzwermen
Marine krijgt concurrentievoordeel met onderzoek naar biologische oceaanzwermen Toenemende fabrieks- en auto-emissies verstoren de natuurlijke cyclus in de Oost-Chinese Zee
Toenemende fabrieks- en auto-emissies verstoren de natuurlijke cyclus in de Oost-Chinese Zee Plaats delict tape gaat een revolutie teweegbrengen in het onderzoek naar microplastics
Plaats delict tape gaat een revolutie teweegbrengen in het onderzoek naar microplastics Door de mens gemaakte massa weegt nu zwaarder dan het leven op aarde:studie
Door de mens gemaakte massa weegt nu zwaarder dan het leven op aarde:studie
Hoofdlijnen
- Wat is het proces waardoor een cel zich verdeelt in 2 dochtercellen die worden genoemd?
- Drie soorten vezelig bindweefsel
- Is schimmels een gewervelde of ongewervelde dieren?
- Wat is kernen dat onstabiel verval heeft bekend als?
- Hoe zijn de unieke ballen van amoebocyten die gevuld zijn met een voedselvoorziening en dienen als beschermende reproductieve structuren die worden genoemd?
- Wordt mitochondriën bekend als het Power House of Cellen?
- Cambacteriën worden gebruikt om menselijke eiwitten te maken?
- Gifpillen gebruiken om bedreigde diersoorten in Australië te beschermen
- Kunnen we een echt Jurassic Park creëren?
- Datawetenschap helpt ingenieurs bij het ontdekken van nieuwe materialen voor zonnecellen en leds
- Onderzoekers ontwikkelen tool om het gedrag van kunststoffen tot op moleculaire schaal te onderzoeken

- Nieuwe sonde kan chirurgen helpen tumoren nauwkeuriger te verwijderen

- Nieuwe op ijzer gebaseerde katalysator verhoogt de omzetting van CO2 naar hogere alcoholen

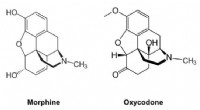
- Minder verslavende opioïden ontwerpen door middel van chemie
 Onderzoekers maken betere kikkererwten mogelijk door genetische eigenschappen van wilde neven te benutten
Onderzoekers maken betere kikkererwten mogelijk door genetische eigenschappen van wilde neven te benutten  Na pandemische onderbreking start Detroit Auto Show zichzelf opnieuw op
Na pandemische onderbreking start Detroit Auto Show zichzelf opnieuw op Economen rapporteren over een bescheiden interventie die gezinnen met lage inkomens helpt de armoedeval te overwinnen
Economen rapporteren over een bescheiden interventie die gezinnen met lage inkomens helpt de armoedeval te overwinnen  Zuckerberg belooft te blijven bouwen in een adres zonder verontschuldiging
Zuckerberg belooft te blijven bouwen in een adres zonder verontschuldiging Kosmische straling helpt supernova-explosies een grotere impact te maken
Kosmische straling helpt supernova-explosies een grotere impact te maken Hoe binomiale kubussen te ontbinden
Hoe binomiale kubussen te ontbinden  Hoe medische scholen via gemeenschapsverbindingen meer verantwoording kunnen afleggen aan de samenleving
Hoe medische scholen via gemeenschapsverbindingen meer verantwoording kunnen afleggen aan de samenleving  Straat in Londen verbiedt benzine, dieselauto's
Straat in Londen verbiedt benzine, dieselauto's
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

