
Wetenschap
Welke zou het vriespunt meer 100 mol suiker of NaCl verlagen?
Inzicht in colligatieve eigenschappen
Bevriezende puntdepressie is een colligatieve eigenschap, wat betekent dat het afhankelijk is van het aantal opgeloste deeltjes in een oplossing, niet op de specifieke identiteit.
* dissociatie: NaCl (natriumchloride) is een ionische verbinding die dissocieert in twee ionen (Na+ en Cl-) wanneer opgelost in water.
* Niet-dissociatie: Suiker (sucrose) is een covalente verbinding en dissocieert niet in water.
De impact van dissociatie
Omdat NaCl in twee ionen dissocieert, zal een 100-mol oplossing van NaCl 200 mol deeltjes hebben in oplossing. Een 100-mol oplossing van suiker heeft slechts 100 mol deeltjes .
Conclusie
De 100-moloplossing van NaCl zal het vriespunt meer verlagen dan de 100-mol oplossing van suiker omdat deze twee keer zoveel deeltjes in oplossing produceert.
 Closed-loop-concept kan de toekomst zijn van duurzame veehouderijen
Closed-loop-concept kan de toekomst zijn van duurzame veehouderijen Doden windturbines vogels?
Doden windturbines vogels?  Hoe levende structuren onze kustlijn beter kunnen beschermen
Hoe levende structuren onze kustlijn beter kunnen beschermen Eerste metingen van jodium in het noordpoolgebied onthullen vragen over luchtvervuiling
Eerste metingen van jodium in het noordpoolgebied onthullen vragen over luchtvervuiling Olie- en gasafvalwater als stofonderdrukker minder dan ideaal
Olie- en gasafvalwater als stofonderdrukker minder dan ideaal
Hoofdlijnen
- De belangrijkste orgaansystemen van het lichaam die betrokken zijn bij het metabolisme of uitscheiding?
- Wat is een gespecialiseerd eiwit geproduceerd door het immuunsysteem dat helpt bij het vernietigen van ziekteverwekkende organismen?
- Ondergewaardeerde microben krijgen nu de eer voor het behouden van twee banen in de bodem
- Feiten over osmose voor kinderen
- Welke vorm van koolhydraten wordt gebruikt door de cel?
- Wat zijn de 4 belangrijkste elementen in organismen?
- Your Brain On: An All Nighter
- Wanneer een groep genparen samenwerken?
- De theorie verklaart waarom 25 procent van de culturen mannelijke geslachtsdelen afsnijdt
- Koolstofvezels van groene voorlopers en geoptimaliseerde processen

- De natuur biedt een sleutel tot het afstoten van vloeistoffen

- Een kus des doods om het onbedwingbare te verdoven
- Onderzoekers ontwikkelen ultrakrachtige plasmonische metaaloxidematerialen

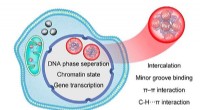
- Moleculair mechanisme van door rutheniumcomplex geïnduceerde DNA-fasescheiding onthuld
 Wat is het totale aantal atomen in 14,5 g natriumacetaat?
Wat is het totale aantal atomen in 14,5 g natriumacetaat?  Is de grens tussen korst en bovenste mantel?
Is de grens tussen korst en bovenste mantel?  Wetenschappelijke benadering heeft zijn intellectuele wortel in?
Wetenschappelijke benadering heeft zijn intellectuele wortel in?  Koper-indiumoxide:een snellere en koelere manier om onze ecologische voetafdruk te verkleinen
Koper-indiumoxide:een snellere en koelere manier om onze ecologische voetafdruk te verkleinen Schoolsluitingen treffen kansarme studenten in de VS onevenredig
Schoolsluitingen treffen kansarme studenten in de VS onevenredig Wat is een Cybathlon?
Wat is een Cybathlon?  Ongebruikelijke ultralichte röntgenbron ontdekt in de melkweg Messier 86
Ongebruikelijke ultralichte röntgenbron ontdekt in de melkweg Messier 86 Bestaat solide uit atomen?
Bestaat solide uit atomen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

