
Wetenschap
Waarom is Gaseous N minder reactief dan Gaseos F?
* stikstofbinding van stikstof: Stikstofatomen in N₂ worden bij elkaar gehouden door een zeer sterke drievoudige binding. Deze binding vereist een aanzienlijke hoeveelheid energie om te breken, waardoor het voor stikstof moeilijk is om met andere stoffen te reageren.
* fluor's hoge elektronegativiteit: Fluor is het meest elektronegatieve element, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Dit maakt fluoratomen zeer reactief, enthousiast om een elektron te krijgen en een stabiele binding te vormen.
* stabiliteit van de elektronenconfiguratie van stikstof: Stikstof heeft een stabiele half gevulde P-orbital, wat bijdraagt aan de lage reactiviteit ervan.
daarentegen: Fluoratomen vormen gemakkelijk enkele bindingen met andere atomen om een volledig octet te bereiken (acht elektronen in de buitenste schaal). Dit maakt fluor een zeer sterk oxidatiemiddel, in staat om met veel stoffen te reageren.
Hier is een samenvatting:
* stikstof (n₂): Sterke drievoudige binding, stabiele elektronenconfiguratie, lage reactiviteit.
* fluor (f₂): Hoge elektronegativiteit, sterk oxidatiemiddel, hoge reactiviteit.
Laat het me weten als je nog andere vragen hebt!
 De helix van het leven:nieuwe studie laat zien hoe RNA zich stabiel bindt aan kunstmatige nucleïnezuren
De helix van het leven:nieuwe studie laat zien hoe RNA zich stabiel bindt aan kunstmatige nucleïnezuren Hoe verschilt de moderne atoomtheorie van de Daltons -theorie?
Hoe verschilt de moderne atoomtheorie van de Daltons -theorie?  Wat beschrijft de entropieverandering als een oplossing van vloeibaar naar vast wordt gemaakt?
Wat beschrijft de entropieverandering als een oplossing van vloeibaar naar vast wordt gemaakt?  Wat zijn de lichtste elementen?
Wat zijn de lichtste elementen?  Verschillen tussen koolstofvezel en fiberglas
Verschillen tussen koolstofvezel en fiberglas
 Doorbraak in satellietbeeldvorming verbetert het vermogen om plantengroei te meten
Doorbraak in satellietbeeldvorming verbetert het vermogen om plantengroei te meten Op de Seychellen, de natuur wordt gewaardeerd boven het massatoerisme
Op de Seychellen, de natuur wordt gewaardeerd boven het massatoerisme Onderzoek wijst uit dat plastic recycling uit Europa wordt gedumpt in Aziatische wateren
Onderzoek wijst uit dat plastic recycling uit Europa wordt gedumpt in Aziatische wateren Bij de dood van dinosaurussen, het ging allemaal om de asteroïde - niet om vulkanen
Bij de dood van dinosaurussen, het ging allemaal om de asteroïde - niet om vulkanen Onderzoek uit Hawaï toont aan dat bijna 75% van de deelnemers aan de natuurbrandenquête in Maui ademhalingsproblemen heeft
Onderzoek uit Hawaï toont aan dat bijna 75% van de deelnemers aan de natuurbrandenquête in Maui ademhalingsproblemen heeft
Hoofdlijnen
- Waar is het fenotype van een dier dat van is gemaakt?
- Waarom sommige uitwerpselen drijven en andere zinken
- Hoe kleine chromosomen met grote concurreren om de aandacht van een cel
- Hoe evolutie de magnetische sensor bij vogels heeft geoptimaliseerd
- Hoe maak je een Bacterial Flowchart
- Wat maakt gymnospermen en angiosperm uniek?
- Wetenschappers onderzoeken het vermogen van prikken om zich aan te passen en te overleven
- Wetenschappers onderzoeken hoe sociale netwerken gedrag beïnvloeden
- Wanneer afscheid nemen? Enquête werpt licht op moeilijke beslissingen voor hondenbezitters
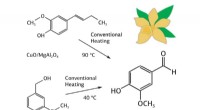
- Chemicus maakt goedkope katalysatoren voor de productie van vanilline
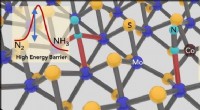
- Ammoniaksynthese gemakkelijk gemaakt met 2D-katalysator
- Nieuwe katalysator verbetert broeikasgas tot hernieuwbare koolwaterstoffen

- De perfecte mix:Optimalisatie van gasmengsels voor waterstofopslag in clathraathydraten

- Eigenschappen van katalysatoren bestudeerd met gammastraalresonantie

 Schaal van online schade aan kinderen onthuld in mondiaal onderzoek
Schaal van online schade aan kinderen onthuld in mondiaal onderzoek  Wat is de binaire verbinding van kalium en stikstof?
Wat is de binaire verbinding van kalium en stikstof?  Wat is de klank van stuiteren?
Wat is de klank van stuiteren?  NASA's Curiosity Mars-rover neemt selfie met Mont Mercou
NASA's Curiosity Mars-rover neemt selfie met Mont Mercou Een apparaat dat de richting of hoeveelheid inspanning verandert die nodig is om werk te doen?
Een apparaat dat de richting of hoeveelheid inspanning verandert die nodig is om werk te doen?  Wat is niet iets dat energie kan doen?
Wat is niet iets dat energie kan doen?  Welk materiaal heeft een slechte energiegeleider?
Welk materiaal heeft een slechte energiegeleider?  Wat zal veranderen als een kracht een object in dezelfde richting als beweging duwt?
Wat zal veranderen als een kracht een object in dezelfde richting als beweging duwt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

