
Wetenschap
Wat gebeurt er in termen van elektronen wanneer lithium reageert met zuurstof?
De reactie
Lithium (Li), een zeer reactief alkalimetaal, reageert gemakkelijk met zuurstof (O 2 ) in de lucht om lithiumoxide te vormen (li 2 O).
elektronenoverdracht
1. Lithium's neiging om elektronen te verliezen: Lithium heeft slechts één valentie -elektron (elektron in de buitenste schaal). Het heeft een sterke neiging om dit elektron te verliezen om een stabiele elektronenconfiguratie te bereiken zoals die van helium.
2. De neiging van Oxygen om elektronen te winnen: Zuurstof heeft daarentegen zes valentie -elektronen. Het moet nog twee elektronen krijgen om een stabiele elektronenconfiguratie te bereiken zoals die van Neon.
3. Elektronenoverdracht: Wanneer lithium reageert met zuurstof, verliest elk lithiumatoom één elektron, dat vervolgens wordt geaccepteerd door een zuurstofatoom. Omdat zuurstof twee elektronen nodig heeft, neemt het één elektron van elk van twee lithiumatomen.
Vorming van ionen
* lithiumkationen: Elk lithiumatoom, dat een elektron heeft verloren, wordt een positief geladen ion (li + ).
* oxide -anionen: Elk zuurstofatoom, dat twee elektronen heeft gewonnen, wordt een negatief geladen ion (o 2- ).
Vorming van lithiumoxide
Deze tegengesteld geladen ionen (li
De chemische vergelijking:
De evenwichtige chemische vergelijking voor de reactie is:
4 li + o 2 → 2 li 2 O
Key Takeaway:
De reactie van lithium met zuurstof omvat de overdracht van elektronen van lithiumatomen naar zuurstofatomen, het vormen van ionen en uiteindelijk leiden tot het creëren van de ionische verbinding lithiumoxide.
 Squirrel Paring en draagtijd
Squirrel Paring en draagtijd  Ongewenste verandering van de zee:uit nieuw onderzoek blijkt dat overstromingen langs de kust tegen 2100 tot 20% van de wereldeconomie kunnen kosten
Ongewenste verandering van de zee:uit nieuw onderzoek blijkt dat overstromingen langs de kust tegen 2100 tot 20% van de wereldeconomie kunnen kosten Nieuw onderzoek verbetert het begrip van oude landschappen
Nieuw onderzoek verbetert het begrip van oude landschappen Wetenschap zegt:waarom biodiversiteit belangrijk voor je is
Wetenschap zegt:waarom biodiversiteit belangrijk voor je is Heeft Zuid-Afrika een probleem met microplastics? Ons onderzoek zegt ja
Heeft Zuid-Afrika een probleem met microplastics? Ons onderzoek zegt ja
Hoofdlijnen
- 10 slechtste aanpassingen in het dierenrijk
- Het werk van welke wetenschapper werd tijdens zijn leven grotendeels genegeerd?
- Wat is het woord dat wordt gebruikt om een dierenplant te beschrijven die zowel mannelijk als vrouwelijk?
- Mendels Experimenten: The Study of Pea Plants & Inheritance
- Welke wetenschapper die verantwoordelijk is voor het weerleggen van de theorie van spontane generatie?
- Wat zijn de twee belangrijkste stadia van de meiose?
- Hoe je hersenen werken
- Wat is een aanpassing voor Dahlia?
- Hoe fruitvliegen hun omgeving opsnuiven
- Moleculaire draden bouwen, één atoom tegelijk
- Een complete set van energieniveauposities van alle primaire metaalhalogenideperovskieten
- Baanbrekende synthesestrategie kan een golf van nieuwe medicinale verbindingen betekenen
- Katalysator met één atoom gebaseerd op homogeen katalyse-prototype voor CO2-transformatie
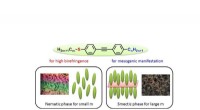
- Zwavel verbetert dubbele breking voor het ontwikkelen van vloeibaar-kristallijne moleculen
 Quibi werkt samen met T-Mobile terwijl het zich voorbereidt op de lancering in april
Quibi werkt samen met T-Mobile terwijl het zich voorbereidt op de lancering in april Air Canada neemt 16 opnieuw in dienst, 500 werknemers ontslagen vanwege pandemie
Air Canada neemt 16 opnieuw in dienst, 500 werknemers ontslagen vanwege pandemie Is lucht is element of compound?
Is lucht is element of compound?  Lijst met landen in de ijskoude zone
Lijst met landen in de ijskoude zone Welke richting is Orion waarmee de constellatie wordt geconfronteerd met Idaho?
Welke richting is Orion waarmee de constellatie wordt geconfronteerd met Idaho?  Pesten verminderen op de Finse manier - in de Verenigde Staten
Pesten verminderen op de Finse manier - in de Verenigde Staten Bepaalt de snelheid van een ster naar of weg van de aarde met het meten van zijn spectrale lijnen?
Bepaalt de snelheid van een ster naar of weg van de aarde met het meten van zijn spectrale lijnen?  Wat is hetzelfde als het meten van energie?
Wat is hetzelfde als het meten van energie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

