
Wetenschap
Hoe wordt een zwavelatoom sulfide -ion waarom het de neiging heeft om dit te doen?
De transformatie
* zwavelatoom: Een zwavelatoom heeft 16 elektronen, gerangschikt in de volgende elektronenconfiguratie:2, 8, 6. Dit betekent dat het 6 valentie -elektronen heeft (elektronen in de buitenste schaal).
* Elektronen verkrijgen: Om een stabiele, edelgasconfiguratie zoals Argon (2, 8, 8) te bereiken, moet zwavel nog twee elektronen krijgen.
* sulfide -ion (s²⁻): Wanneer een zwavelatoom twee elektronen krijgt, wordt het een sulfide -ion (S²⁻). Dit ion heeft nu een volledige buitenste schaal van 8 elektronen, waardoor het stabieler wordt.
Waarom de neiging?
* octetregel: Atomen streven ernaar om een volledige buitenste schaal van 8 elektronen te bereiken, een toestand die bekend staat als de octetregel. Deze configuratie biedt verhoogde stabiliteit.
* electro -negativiteit: Zwavel is relatief elektronegatief, wat betekent dat het een sterke aantrekkingskracht heeft op elektronen. Hierdoor worden het waarschijnlijker om elektronen te krijgen om zijn octet te voltooien.
* ionische binding: De vorming van sulfide -ionen is een belangrijk onderdeel van ionische binding. Wanneer zwavel interageert met een metaal, doneert het metaalatoom elektronen aan het zwavelatoom, wat resulteert in de vorming van het sulfide -ion en een positief geladen metaalion. Dit creëert een sterke elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen, die een ionische verbinding vormen.
Samenvattend
Zwavelatomen worden de neiging om sulfide -ionen te worden, omdat het verkrijgen van twee elektronen hen in staat stelt een stabiele elektronenconfiguratie te bereiken, waardoor de octetregel wordt vervuld. Deze neiging drijft de vorming van ionische verbindingen aan, die essentieel zijn in verschillende chemische reacties en materialen.
 Welk type product wordt gevormd bij reactie en alcohol met Na -metaal?
Welk type product wordt gevormd bij reactie en alcohol met Na -metaal?  Wat wordt zout beschouwd als bij het oplossen van water?
Wat wordt zout beschouwd als bij het oplossen van water?  Wat betekent primair extractie van grondstoffen?
Wat betekent primair extractie van grondstoffen?  Wat is de chemische formule voor een verbinding met 4 chlooratomen en 1 koolstof?
Wat is de chemische formule voor een verbinding met 4 chlooratomen en 1 koolstof?  Welk element (en) gecombineerd met chloor?
Welk element (en) gecombineerd met chloor?
 Voordelen en nadelen van roterende schroefluchtcompressoren
Voordelen en nadelen van roterende schroefluchtcompressoren  Hoe je over klimaatverandering kunt praten, zodat mensen actie ondernemen
Hoe je over klimaatverandering kunt praten, zodat mensen actie ondernemen  Hoe je invasieve ratten en muizen thuis kunt bestrijden zonder de inheemse fauna te schaden
Hoe je invasieve ratten en muizen thuis kunt bestrijden zonder de inheemse fauna te schaden  Mountain Lion Poop
Mountain Lion Poop Buurtvergroening kan leiden tot gentrificatie en ontheemding
Buurtvergroening kan leiden tot gentrificatie en ontheemding
Hoofdlijnen
- Welke vormen tussen de verdeelde kern tijdens cytokenesis in plantencellen?
- Welke processen veroorzaken het vrijkomen van water uit levende organismen in de atmosfeer?
- Welk lichaamssysteem behoort cerebellum?
- Wat zou u gebruiken om het reproductieve succes van een plant te beoordelen?
- Wat is de moleculaire basis voor verschil in elektroforetisch patroon tussen normale hemoglobine A en S?
- Walvisstranden:vijf vragen beantwoord
- Hoe verschilt een orgel van het systeem?
- Zal de paling het beheer ervan overleven?
- Wat zijn de vier phyla van protozoën?
- Een nieuwe manier om verspild methaan te benutten
- Grote doorbraak in de productie van rode bloedcellen
- Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
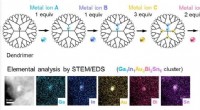
- Doorbraak in het mengen van metalen - nauwkeurige controle van multimetallische clustervorming van één nanometer bereikt
- Bacterieel cellulose-afbraaksysteem kan de productie van biobrandstoffen stimuleren
 Wat is het proces door welk water een damp wordt?
Wat is het proces door welk water een damp wordt?  Wanneer is onmiddellijke versnelling en gemiddeld hetzelfde?
Wanneer is onmiddellijke versnelling en gemiddeld hetzelfde?  Een nieuw natuurlijk blauw voor voedselkleuring
Een nieuw natuurlijk blauw voor voedselkleuring Science Fair Projecten over planten: groeien ze sneller met frisdrank, water of gatorade?
Science Fair Projecten over planten: groeien ze sneller met frisdrank, water of gatorade?  Wordt een massa of gewicht bepaald door de zwaartekracht?
Wordt een massa of gewicht bepaald door de zwaartekracht?  Hoe draait de aarde rond de maan?
Hoe draait de aarde rond de maan?  Wat is een afwisselende hoeveelheid?
Wat is een afwisselende hoeveelheid?  Beheersing van de magnetische eigenschappen van complexe oxidesystemen
Beheersing van de magnetische eigenschappen van complexe oxidesystemen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

