
Wetenschap
Hoe verandert een stof van de ene toestand van materie naar de andere?
De staten van materie
* solide: Deeltjes zijn strak verpakt en trillen in vaste posities.
* vloeistof: Deeltjes zijn dichterbij dan in een gas, maar kunnen zich om elkaar heen bewegen.
* gas: Deeltjes liggen ver uit elkaar en bewegen vrij.
overgangen
1. smelten: Vast tot vloeistof. Warmte -energie wordt geabsorbeerd, waardoor deeltjes sterker trillen en loskomen van hun vaste posities.
2. Bevriezen: Vloeistof tot vast. Warmte -energie komt vrij, waardoor deeltjes vertragen en een meer rigide structuur vormen.
3. VAPORISATIE/KOOKEN: Vloeistof naar gas. Warmte -energie wordt geabsorbeerd, waardoor deeltjes sneller bewegen en de krachten overwinnen die ze bij elkaar houden.
4. Condensatie: Gas tot vloeistof. Warmte -energie wordt vrijgegeven, waardoor deeltjes vertragen en samen klonten.
5. Sublimatie: Vast tot gas. Warmte -energie wordt geabsorbeerd, waardoor deeltjes de vloeibare fase omzeilen en direct gas worden.
6. Afzetting: Gas tot vast. Warmte -energie komt vrij, waardoor deeltjes de vloeibare fase omzeilen en direct vast worden.
Factoren die de wijzigingen van de toestand beïnvloeden
* Temperatuur: Hogere temperaturen bieden meer energie voor deeltjes om te bewegen.
* Druk: Verhoogde drukkrachten deeltjes dichter bij elkaar, wat een meer gecondenseerde toestand bevordert.
* intermoleculaire krachten: De sterkte van aantrekkingskracht tussen deeltjes beïnvloedt de energie die nodig is voor faseveranderingen.
Denk er op deze manier aan: Stel je een menigte mensen voor.
* solide: Iedereen staat dicht bij elkaar, strak verpakt en nauwelijks bewegend.
* vloeistof: Mensen zijn nog steeds dichtbij, maar kunnen zich om elkaar heen bewegen.
* gas: Iedereen is verspreid en beweegt zich vrij.
Het toevoegen van energie (zoals warmte) is alsof je de menigte meer energie geeft om te bewegen. Het verwijderen van energie (zoals koelen) is als ze moe maken en dichter bij elkaar willen staan.
 Kan vervuiling bomen helpen infecties te bestrijden?
Kan vervuiling bomen helpen infecties te bestrijden?  Wat zijn enkele manieren waarop zeesterren zich aanpassen aan hun omgeving?
Wat zijn enkele manieren waarop zeesterren zich aanpassen aan hun omgeving?  Een Europa bedekt met graslanden of bossen:innovatie en onderzoek naar klimaatmodellen
Een Europa bedekt met graslanden of bossen:innovatie en onderzoek naar klimaatmodellen Australië ziet voor vierde maand op rij recordtemperaturen
Australië ziet voor vierde maand op rij recordtemperaturen Ideeën voor Science Fair-projecten op vis
Ideeën voor Science Fair-projecten op vis
Hoofdlijnen
- Welke van de volgende bacteriën vertoont echte beweeglijkheid op objectglaasjes bij B.cereus P.aeruginosa en S.volutans?
- Menselijk genoom DNA-sequentietypen
- Welke belangrijke functie hebben nucleïnezuren in een cel?
- 10 geweldige dingen die de hersenen van mensen hebben gedaan
- Een groep gespecialiseerde cellen vormt eerst een?
- Wat is het tweede deel in de wetenschappelijke methode?
- Wat is een kenmerk dat doorgaans niet wordt gebruikt om biomen te classificeren?
- Wat is een vraag die je probeert te beantwoorden in het laboratorium?
- Veel ziekteverwekkers verwonden de gastheer door wat te produceren?
- Chemici bereiken moleculaire bewerkingsprestatie
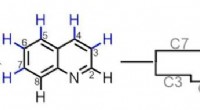
- Kunstmatig longkankerweefsel kan helpen bij het vinden van nieuwe medicamenteuze behandelingen

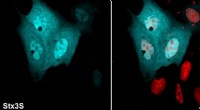
- Klasse van eiwitten die betrokken zijn bij essentiële celfuncties heeft een onverwachte rol, wetenschappers ontdekken
- Eenvoudige methode om carbonzuren om te zetten in boronaatesters en boronzuren

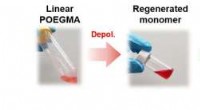
- Plastic afbreken in zijn samenstellende delen
 Wat zijn energiegolven die door de lucht bewegen?
Wat zijn energiegolven die door de lucht bewegen?  Waarom zijn windwater en zonlicht hernieuwbare energiebronnen?
Waarom zijn windwater en zonlicht hernieuwbare energiebronnen?  Hoe de wiskunde van deeltjesversnellers mij heeft geholpen mijn wifi te repareren
Hoe de wiskunde van deeltjesversnellers mij heeft geholpen mijn wifi te repareren  De meting van kinetische of thermische energie staat bekend als wat?
De meting van kinetische of thermische energie staat bekend als wat?  Welke term wordt gebruikt om de belangrijkste energiebron te beschrijven die het weer op aarde bepalen?
Welke term wordt gebruikt om de belangrijkste energiebron te beschrijven die het weer op aarde bepalen?  Orions eerste Service Module integratie compleet
Orions eerste Service Module integratie compleet Onderzoekers stellen airconditioners voor als remedie tegen klimaatverandering
Onderzoekers stellen airconditioners voor als remedie tegen klimaatverandering Ingenieurs vertalen hersensignalen direct in spraak
Ingenieurs vertalen hersensignalen direct in spraak
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

