
Wetenschap
Welke heeft bindingen die de meeste polaire SCL2 F2 CS2 CF4 BRCL zijn?
Polariteit begrijpen
* Polaire covalente bindingen: Tijdens het optreden wanneer elektronen ongelijk worden gedeeld tussen atomen. Dit gebeurt wanneer de atomen verschillende elektronegativiteiten hebben. Elektronegativiteit is een maat voor het vermogen van een atoom om elektronen aan te trekken.
* Elektronegativiteitsverschillen: Hoe groter het verschil in elektronegativiteit tussen twee atomen, hoe meer polair de binding.
Analyse van de moleculen
1. SCL2: Zwavel en chloor hebben elektronegativiteitsverschillen, maar chloor is meer elektronegatief. Dit creëert polaire bindingen.
2. F2: Beide fluoratomen hebben dezelfde elektronegativiteit, dus de binding is niet -polair.
3. CS2: Koolstof en zwavel hebben vergelijkbare elektronegativiteiten, waardoor de binding meestal niet -polair is.
4. CF4: Koolstof en fluor hebben een aanzienlijk elektronegativiteitsverschil, waardoor zeer polaire bindingen ontstaan.
5. brcl: Bromine en chloor hebben vergelijkbare elektronegativiteiten, waardoor de binding enigszins polair is, maar minder dan CF4.
Conclusie
CF4 (koolstof tetrluoride) heeft de meeste polaire bindingen Omdat het elektronegativiteitsverschil tussen koolstof en fluor het grootste is bij de vermelde moleculen.
 Het regent op het Groenlandse ijs - in de winter
Het regent op het Groenlandse ijs - in de winter Hoe eigenschappen van roofdieren de anti-roofdierreactie bepalen
Hoe eigenschappen van roofdieren de anti-roofdierreactie bepalen  Opwarming van de aarde blijkt de boosdoener te zijn voor het overstromingsrisico in de Peruaanse Andes, andere gletsjermeren
Opwarming van de aarde blijkt de boosdoener te zijn voor het overstromingsrisico in de Peruaanse Andes, andere gletsjermeren Circulaire steden van de wereld:wat kan groene infrastructuur doen?
Circulaire steden van de wereld:wat kan groene infrastructuur doen? Vervuild Londen zet zijn zinnen op auto's
Vervuild Londen zet zijn zinnen op auto's
Hoofdlijnen
- Wanneer een cel zich voorbereidt om zich te verdelen om zijn dochter alle informatie te hebben die hij moet overzien?
- Ontbrekende visvangstgegevens? Niet noodzakelijkerwijs een probleem, zegt een nieuwe studie
- Wat eten Carnivores Plant?
- Wanneer wordt een foetus twee cellen?
- Gesteenten beïnvloeden aangrenzende bodems en plantengroei op fijne schalen in karstgebieden
- Wat is een systeem dat bestaat uit de darmen en longen van de nieren leverhuid en longen zuivert het lichaam door afvalmateriaal te elimineren?
- Wat is het type kraakbeen geassocieerd met botfunctie en ontwikkeling?
- Welke rol speelt weefsel en cellen bij de spijsvertering?
- Hoe ontwikkelden bacteriën zich voor het eerst op aarde?
- Polymeer om ammoniakvervuiling op te vangen gerealiseerd

- Genoommining leidt tot een nieuw type peptide-prenylatie
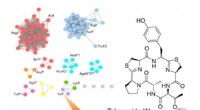
- Frontale polymerisatie afstemmen op diverse materiaaleigenschappen
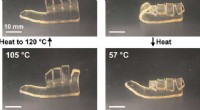
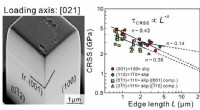
- Micropijlercompressie voor het vinden van hittebestendige legeringen
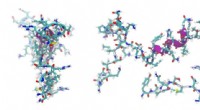
- Onderzoekers ontwikkelen een nieuw peptidesysteem voor gericht transport van moleculen naar levende zoogdiercellen
 Hoe kunt u bariumsulfaat scheiden van kaliumchloride?
Hoe kunt u bariumsulfaat scheiden van kaliumchloride?  Australië zou minder cyclonen kunnen zien, maar meer hitte- en brandgevaar in de komende maanden
Australië zou minder cyclonen kunnen zien, maar meer hitte- en brandgevaar in de komende maanden Wat is de hardheid van calcine?
Wat is de hardheid van calcine?  Welke cellen geproduceerd door fusie van monocyten?
Welke cellen geproduceerd door fusie van monocyten?  Hoe vind je de snelheid van een vallend object?
Hoe vind je de snelheid van een vallend object?  Hoe probiotische bifidobacteriën patiënten met coeliakie kunnen helpen?
Hoe probiotische bifidobacteriën patiënten met coeliakie kunnen helpen? Foliation is de opstelling van mineralen in?
Foliation is de opstelling van mineralen in?  Wat is een zeekanyon?
Wat is een zeekanyon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

