Wetenschap
Onderzoekers ontwikkelen een nieuw peptidesysteem voor gericht transport van moleculen naar levende zoogdiercellen
Tegoed:CC0 Publiek Domein
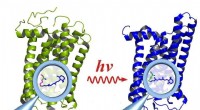
Een nieuw peptide, ontwikkeld aan de universiteiten van Bayreuth en Bristol, is bij uitstek geschikt voor het doelgericht transporteren van moleculen, bijvoorbeeld van actieve stoffen en kleurstoffen, in de cellen van zoogdieren. Het peptide wordt gekenmerkt door een dubbele functie:het kan de cel van buitenaf binnendringen en daar interageren met een partnerpeptide. Het partnerpeptide moet eerder in de cel zijn geplaatst, precies waar de getransporteerde moleculen moeten werken. Het transportsysteem gepresenteerd in het tijdschrift Nature Chemical Biology illustreert het veelbelovende potentieel van een de novo ontwerp van peptiden en eiwitten.
In de afgelopen jaren hebben de biogeneeskunde en farmacologie een groot aantal actieve stoffen ontwikkeld die in staat zijn om processen in zoogdiercellen op gang te brengen, te versterken of te remmen. Het is echter in veel gevallen nog een uitdaging om deze stoffen precies daar te vervoeren waar ze nodig zijn. De situatie is vergelijkbaar als het gaat om het kleuren van bepaalde structuren in cellen voor onderzoeks- of diagnostische doeleinden. Het is waar dat zoogdiercellen het vermogen hebben om vreemde stoffen op te nemen via endocytose. Maar dit garandeert geenszins transport naar de gewenste plaats van actie. Een nieuwe onderzoeksaanpak die de Bayreuth-biochemicus prof. dr. Birte Höcker met haar onderzoeksgroep nastreeft, is het rationele ontwerp van peptiden. Deze moeten van buitenaf in het celinterieur kunnen doordringen en aangehechte werkzame stoffen of kleurstofmoleculen kunnen meenemen. Peptiden die voor dit doel geschikt zijn, zijn vrij klein omdat ze meestal uit minder dan 30 aminozuren bestaan.
Tot nu toe was het probleem echter dat dergelijke peptiden - juist vanwege hun eenvoud en kleine omvang - niet veel mogelijke toepassingen bieden. Dit komt omdat er maar een paar gebieden in de diverse structuren van het celinterieur zijn waar ze de moleculen die ze transporteren kunnen aanmeren en afleveren. Dit nadeel is overwonnen door het in Bayreuth en Bristol ontwikkelde peptide. Het is een basisch peptide met een hoog gehalte aan arginine-aminozuren en het heeft twee componenten die essentieel zijn voor zijn functionaliteit. De ene laat het peptide toe om het celinterieur binnen te gaan en de andere is in staat om te interageren met een zuur partnerpeptide. Dit partnerpeptide is zodanig dat het op zeer verschillende locaties in de cel kan worden geplaatst met behulp van gevestigde biochemische methoden. Zodra eiwitten, grotere moleculaire complexen of organellen zijn gelabeld met het partnerpeptide, kunnen ze worden aangevallen door het basispeptide dat de cel is binnengekomen. Als een sleutel in een slot grijpt het basispeptide zich vast aan het zure peptide. De gerichte plaatsing van het zure partnerpeptide wordt bereikt door het te koppelen aan moleculen die op hun beurt door transfectie in het DNA van de cel worden ingebracht.
Het Anglo-Duitse onderzoeksteam ontwierp de twee voorheen onbekende de novo-peptiden met behulp van computerondersteunde eiwitontwerpmethoden. De basis voor dit werk waren peptiden met een opgerolde structuur, die werden beschreven in een structuurdatabase. De op de computer ontworpen peptiden werden vervolgens in het laboratorium gesynthetiseerd. Hier werden biofysische methoden en röntgenkristallografie gebruikt om de echte eigenschappen en het gedrag van de peptiden te identificeren. Experimenten met E. coli-bacteriën en eukaryote cellen lieten zien dat het nieuwe peptidesysteem zelfs geschikt is voor het transport van andere peptiden en eiwitten.
"Onze onderzoeken illustreren hoe het computationele ontwerp van peptiden en eiwitten, hun daaropvolgende synthese en karakterisering in het laboratorium, evenals testen in levende cellen met elkaar verweven kunnen worden wanneer innovatieve oplossingen voor biochemische of biomedische vragen worden gezocht", zegt Prof. Dr. Birte Höcker, hoofd van de Protein Design Group aan de Universiteit van Bayreuth en corresponderende auteur van de nieuwe studie.
"The new peptide system makes it clear that de novo design is a promising research approach in the search for methods that enable drug or dye molecules to be introduced into mammalian cells in a targeted and gentle manner," adds Dr. Guto Rhys, postdoc at the Protein Design research group and one of the three first authors. + Verder verkennen
Fluorescent peptide nanoparticles, in every color of the rainbow
 Hoe de duurzaamheidsleiders van morgen kunnen profiteren van eerdere successen en valkuilen
Hoe de duurzaamheidsleiders van morgen kunnen profiteren van eerdere successen en valkuilen De mensheid neemt kolossale risico's met onze toekomst:Nobels
De mensheid neemt kolossale risico's met onze toekomst:Nobels Onderzoekers ontdekken een nieuwe, jonge vulkaan in de Stille Oceaan
Onderzoekers ontdekken een nieuwe, jonge vulkaan in de Stille Oceaan Ontdekking van metamorfe diamanten in het noordoosten van Queensland zou aanwijzingen kunnen geven over hoe Australië is ontstaan
Ontdekking van metamorfe diamanten in het noordoosten van Queensland zou aanwijzingen kunnen geven over hoe Australië is ontstaan Aarde bereikt binnen 20 tot 30 jaar een temperatuuromslagpunt nieuwe studie vondsten
Aarde bereikt binnen 20 tot 30 jaar een temperatuuromslagpunt nieuwe studie vondsten
Hoofdlijnen
- Groot-Brittannië kondigt plan aan om handel in antiek ivoor te verbieden
- Jonge, koelbloedige dieren lijden het meest door de opwarming van de aarde, blijkt uit onderzoek
- Onderzoekers rapporteren een fundamentele spiersnelheidslimiet
- Duizenden burgerwetenschappers helpen onderzoekers kelpbossen in kaart te brengen
- Trofisch niveau (voedselketen en web): definitie en voorbeelden (met diagram)
- Fun Biology Presentatie Onderwerpen
- Wat fossielen onthullen over hybridisatie van vroege mensen
- Hoe isoleer ik bacteriën uit de bodem?
- Wat moet er gebeuren met de DNA-strengen in de kern voordat de cel kan delen?
 De kracht van AI benutten om warme, dichte materie te begrijpen
De kracht van AI benutten om warme, dichte materie te begrijpen Studie:Neanderthalers liepen risico's, maar dat deden onze voorouders ook
Studie:Neanderthalers liepen risico's, maar dat deden onze voorouders ook Californië schakelt stroom uit voor miljoenen mensen om bosbranden te voorkomen
Californië schakelt stroom uit voor miljoenen mensen om bosbranden te voorkomen Wat zijn de drie verschillende soorten convergente grenzen?
Wat zijn de drie verschillende soorten convergente grenzen?  Meer landen dan ooit getroffen door bosbranden in 2018
Meer landen dan ooit getroffen door bosbranden in 2018 Zonnecyclus 25:De zon wordt wakker
Zonnecyclus 25:De zon wordt wakker Europese bedrijven zeggen dat zakendoen in China moeilijker is
Europese bedrijven zeggen dat zakendoen in China moeilijker is Een high-yieldmethode voor het samenstellen van gerichte nanodeeltjesclusters
Een high-yieldmethode voor het samenstellen van gerichte nanodeeltjesclusters
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com