
Wetenschap
Wat is het verschil tussen jodide en chloride?
1. Atomisch nummer en grootte:
* jodium (I) heeft een hoger atoomnummer (53) dan chloor (CL) (17). Dit betekent dat jodium meer protonen en elektronen heeft, waardoor het een groter atoom is.
* jodide-ionen (i-) zijn groter dan chloride-ionen (Cl-) Vanwege het grotere aantal elektronenschalen.
2. Reactiviteit:
* jodium is minder reactief dan chloor. Dit komt door de zwakkere aantrekkingskracht tussen de jodiumkern en zijn buitenste elektronen.
* jodide -ionen zijn minder reactief dan chloride -ionen. Ze hebben minder kans om deel te nemen aan chemische reacties.
3. Biologisch belang:
* jodide is essentieel voor de productie van schildklierhormonen. Deze hormonen reguleren metabolisme, groei en ontwikkeling.
* chloride is een belangrijke component van lichaamsvloeistoffen, inclusief bloed en lymfe. Het speelt een rol bij het handhaven van vloeistofbalans en zenuwimpulsoverdracht.
4. Toepassingen:
* jodide wordt gebruikt bij de productie van desinfectiemiddelen, geneesmiddelen en fotografische chemicaliën.
* chloride wordt gebruikt bij de productie van kunststoffen, desinfectiemiddelen en verschillende andere industriële chemicaliën.
5. Interacties met andere elementen:
* jodide kan reageren met andere elementen om verbindingen te vormen zoals kaliumjodide (ki) , die wordt gebruikt als een bron van jodium voor de schildklier.
* chloride kan reageren met andere elementen om verbindingen zoals natriumchloride (NaCl) te vormen , algemeen bekend als tafelzout.
Samenvattend:
Jodide en chloride zijn beide belangrijke ionen met verschillende eigenschappen. Hun verschillen in reactiviteit, grootte en biologische functies leiden tot hun diverse toepassingen en rollen in het menselijk lichaam en de omgeving.
 Wat zijn de redenen waarom een enorme hoeveelheid zoet water op aarde onbruikbaar is?
Wat zijn de redenen waarom een enorme hoeveelheid zoet water op aarde onbruikbaar is?  Principes voor het modelleren van aardoppervlaksystemen en hun eco-omgevingscomponenten
Principes voor het modelleren van aardoppervlaksystemen en hun eco-omgevingscomponenten NASA vindt potentieel voor zware regenval in nieuwe tropische cycloon Pola
NASA vindt potentieel voor zware regenval in nieuwe tropische cycloon Pola Proces in New York over klimaatverklaringen van Exxons
Proces in New York over klimaatverklaringen van Exxons Wetenschap zegt:recordhitte, branden verergerd door klimaatverandering
Wetenschap zegt:recordhitte, branden verergerd door klimaatverandering
Hoofdlijnen
- Waar bevindt de kern zich in een plantencel?
- Hoe kunnen foresice-wetenschappers DNA gebruiken bij een misdaad?
- Heeft de evolutie ons gevormd of drijven we alleen maar die kant op?
- Welk type molecuul zit er in een blad?
- Nieuw multi-task deep learning-framework integreert grootschalige proteomics- en transcriptomics-gegevens van één cel
- Louis Pasteur: Biografie, uitvindingen, experimenten en feiten
- Waar strijden organismen volgens de evolutietheorie van Darwin om?
- Tijger botten? Leeuw botten? Een bijna uitgestorven cycad? DNA-controles ter plaatse bij aankomsthavens
- Prehistorische skeletten van vrouwen tonen impact van rigoureuze handenarbeid
- Een betere batterij bouwen, laag voor laag
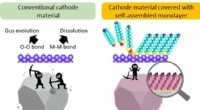
- Biochar kan koolstofopslag stimuleren, maar voordelen voor kieming en groei lijken schaars

- Dageraad van organische eenkristalelektronica
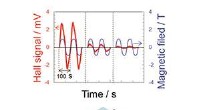
- Nieuwe tool kan schadelijke blauwgroene algen identificeren

- Monsanto verliest beroep in Franse boerenvergiftigingszaak (update)

 Wat zijn de kenmerken van niet-levende dingen?
Wat zijn de kenmerken van niet-levende dingen?  Afnemende instroom in stroomgebieden:een ramp met de watervoorziening in de maak?
Afnemende instroom in stroomgebieden:een ramp met de watervoorziening in de maak? Wat is de theorie van plaattektoniek over de?
Wat is de theorie van plaattektoniek over de?  Waarom wordt duisternis de echte moordenaar na asteroïden die op aarde zijn gevolgen?
Waarom wordt duisternis de echte moordenaar na asteroïden die op aarde zijn gevolgen?  Hoe maanlandingen werken
Hoe maanlandingen werken  Hoogste piekvermogen en uitstekende stabiliteit aangetoond in een laser
Hoogste piekvermogen en uitstekende stabiliteit aangetoond in een laser Hoe wordt de studie van planten en dieren in interne onderdelen genoemd?
Hoe wordt de studie van planten en dieren in interne onderdelen genoemd?  Wat is de belangrijkste klasse van rotsvormende mineralen op aarde?
Wat is de belangrijkste klasse van rotsvormende mineralen op aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

