
Wetenschap
Wat is de reactie van het toevoegen van ijzeroxide aan een zuur?
1. IJzer (ii) oxide (FeO) met zuur:
* reactie: Feo + 2H⁺ → Fe²⁺ + H₂o
* Beschrijving: IJzer (II) Oxide reageert met zuren om ijzer (II) ionen (Fe²⁺) en water te vormen.
* Voorbeeld: Feo + 2HCl → Fecl₂ + H₂o
2. IJzer (iii) oxide (fe₂o₃) met zuur:
* reactie: Fe₂o₃ + 6h⁺ → 2fe³⁺ + 3h₂o
* Beschrijving: IJzer (III) oxide reageert met zuren om ijzer (III) ionen (Fe³⁺) en water te vormen.
* Voorbeeld: Fe₂o₃ + 6Hno₃ → 2Fe (No₃) ₃ + 3H₂o
3. IJzer (ii, iii) oxide (fe₃o₄) met zuur:
* reactie: Fe₃o₄ + 8h⁺ → 2fe³⁺ + fe²⁺ + 4h₂o
* Beschrijving: IJzer (II, III) oxide, ook bekend als magnetiet, reageert met zuren om zowel ijzer (II) als ijzer (III) ionen te vormen, samen met water.
* Voorbeeld: Fe₃o₄ + 8hcl → 2fecl₃ + fecl₂ + 4h₂o
belangrijke opmerkingen:
* Sterkte van het zuur: De reactiesnelheid en omvang van de reactie hangt af van de sterkte van het gebruikte zuur. Sterkere zuren zoals zoutzuur (HCL) en salpeterzuur (HNO₃) zullen gemakkelijker en volledig reageren.
* Vorming van zouten: De reactie tussen ijzeroxiden en zuren vormt in het algemeen ijzerzouten. Het gevormde specifieke zout is afhankelijk van het gebruikte zuur (bijv. Fecl₂ met HCl, Fe (No₃) ₃ met HNO₃).
* Oxidatietoestand: De oxidatietoestand van ijzer in het ijzeroxide bepaalt de oxidatietoestand van ijzer in het resulterende zout.
* Warmte -generatie: De reactie is vaak exotherme, wat betekent dat het warmte vrijgeeft.
Samenvattend:
De reactie van ijzeroxide met een zuur resulteert in de vorming van ijzerionen en water. Het specifieke type ijzeroxide en het gebruikte zuur bepalen de exacte producten en reactieomstandigheden.
 Steden opnieuw verwilderen:groener teruggroeien, schoner en gezonder
Steden opnieuw verwilderen:groener teruggroeien, schoner en gezonder Unieke kenmerken van woestijnen
Unieke kenmerken van woestijnen  Wat zijn natuurlijke hulpbronnen?
Wat zijn natuurlijke hulpbronnen?  Subsidies meest effectieve manier om duurzame voedselkeuzes te stimuleren, studie toont
Subsidies meest effectieve manier om duurzame voedselkeuzes te stimuleren, studie toont Genetische tests tonen aan dat palmbomen uit Centraal-Australië recentelijker zijn afgeweken van het noorden dan gedacht
Genetische tests tonen aan dat palmbomen uit Centraal-Australië recentelijker zijn afgeweken van het noorden dan gedacht
Hoofdlijnen
- Is schizofrenie samen met onze hersenen geëvolueerd?
- Wat is het proces van stoffen die een cel laten roepen?
- Hoe Spaced Repetition examen tijd een fluitje van een cent kan maken
- Vreemde wereld van Australische bijen:hoe één soort genderevenwicht in het nest creëert
- Verandering in de gencode kan verklaren hoe menselijke voorouders staarten verloren
- Hoe meer leren over massale nesten kan helpen bij het behoud van zeeschildpadden
- Kunnen windturbines en trekvogels naast elkaar bestaan?
- Wat is STEM-onderwijs?
- Tot een hoogtepunt komen:hoe gewervelde dieren roofdieren werden door de neurale lijst aan te passen
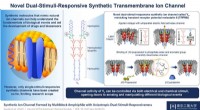
- Dubbel genot:nieuw synthetisch transmembraan-ionkanaal kan op twee manieren worden geactiveerd
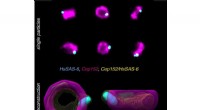
- Superresolutiemicroscopie bouwt multicolor 3D van 2D
- Onderzoekers krijgen controle over de synthese van zachte moleculen

- Onderzoekers gebruiken de natuur om kogelvrije coatings te maken

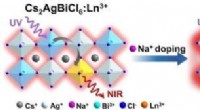
- Efficiënte nabij-infrarode luminescentie in met lanthanide gedoteerde, volledig anorganische halide dubbele perovskieten
 Laboratoriumexperimenten laten zien waarom middelgrote mieren niet uit de kuilen van mierenleeuwlarven kunnen kruipen
Laboratoriumexperimenten laten zien waarom middelgrote mieren niet uit de kuilen van mierenleeuwlarven kunnen kruipen  Is het mogelijk om energie te vernietigen of te creëren?
Is het mogelijk om energie te vernietigen of te creëren?  Ultrakoude atomen gebruiken om massavernietigingswapens te vinden
Ultrakoude atomen gebruiken om massavernietigingswapens te vinden Wat is de biologische ontdekking over cellen gemaakt door Robert Hooke?
Wat is de biologische ontdekking over cellen gemaakt door Robert Hooke?  Wat hebben zonlichtbodemlucht en water gemeen?
Wat hebben zonlichtbodemlucht en water gemeen?  Innovatieve fotokatalytische materialen van koolstofnanobuisjes voor efficiënte omzetting van zonne-energie en waterstofproductie
Innovatieve fotokatalytische materialen van koolstofnanobuisjes voor efficiënte omzetting van zonne-energie en waterstofproductie Welke plant heeft meer chlorofylzon of schaduwplant?
Welke plant heeft meer chlorofylzon of schaduwplant?  Deze structuur van het neuron speelt een rol vergelijkbaar met rubbercoating?
Deze structuur van het neuron speelt een rol vergelijkbaar met rubbercoating?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

