
Wetenschap
24G CH4 reageert met 96 g O2?
1. De chemische vergelijking
De reactie van methaan (CH4) en zuurstof (O2) is een verbrandingsreactie, die koolstofdioxide (CO2) en water (H2O) produceert:
CH4 + 2O2 → CO2 + 2H2O
2. Stoichiometrie
De vergelijking vertelt ons het volgende:
* 1 mol CH4 reageert met 2 mol O2
* 1 mol CH4 produceert 1 mol CO2
* 1 mol CH4 produceert 2 mol H2O
3. Molaire massa's
* CH4:12.01 g/mol (c) + 4 * 1.01 g/mol (h) =16,05 g/mol
* O2:2 * 16.00 g/mol (o) =32,00 g/mol
4. Berekeningen
* mol CH4: 24 g / 16,05 g / mol =1,5 mol
* mol O2: 96 g / 32,00 g / mol =3 mol
5. Beperkende reactant
* van de vergelijking: 1 mol CH4 heeft 2 mol O2 nodig.
* We hebben: 1,5 mol CH4 en 3 mol O2.
* Dit betekent: We hebben genoeg O2 om met alle CH4 te reageren. CH4 is de beperkende reactant.
6. Productberekeningen
* CO2 geproduceerd: 1,5 mol CH4 * (1 mol CO2 / 1 mol CH4) =1,5 mol CO2
* Mass van CO2: 1,5 mol * 44.01 g/mol =66,02 g
* H2O geproduceerd: 1,5 mol CH4 * (2 mol H2O / 1 mol CH4) =3 mol H2O
* Mass van H2O: 3 mol * 18,02 g/mol =54,06 g
Conclusie
Wanneer 24 g CH4 reageert met 96 g O2:
* CH4 is de beperkende reactant.
* 66.02 g CO2 en 54.06 g H2O worden geproduceerd.
 Eerste aanwijzingen voor het begin van de supercontinentcyclus van de aarde gevonden
Eerste aanwijzingen voor het begin van de supercontinentcyclus van de aarde gevonden Hoe beïnvloedt de hoogte het plantenleven?
Hoe beïnvloedt de hoogte het plantenleven?  De afvalrevolutie in New York richt zich op het overvolle afval en de ratten die ervan smullen
De afvalrevolutie in New York richt zich op het overvolle afval en de ratten die ervan smullen  Wat is het de cirkelen van het ene object over het andere?
Wat is het de cirkelen van het ene object over het andere?  Amerikaanse jongeren klagen voor een leefbaar klimaat
Amerikaanse jongeren klagen voor een leefbaar klimaat
Hoofdlijnen
- Ontdek nieuwe details over antibioticaresistentie uit melkmonsters uit de jaren veertig
- Waarom zijn ondiepe meren vatbaar voor eutrofiëring?
- Wat zou je verwachten te zien in een plantencel maar geen dierlijke cellen?
- Waarom de wetenschap niet helpt bij het verkopen van chocoladekoekjes
- In welke organel komt cellulaire ademhaling op?
- Wat is de systematisering van kennis?
- Studie wakkert de discussie aan over waarom vrouwtjesvogels extra partners zoeken
- Wat laat bepaalde materialen in en uit de cel passeren?
- Hoe bacteriële cellen hun eigen DNA herkennen
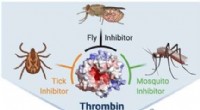
- Krachtige trivalente remmers van trombine uit antistollingspeptiden in speeksel van insecten
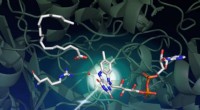
- Wetenschappers ontdekken structuur van door licht aangedreven enzym met mogelijke toepassingen voor biobrandstof
- Groene waterstof:op drijfvermogen gebaseerde convectie in de elektrolyt

- Nieuw model voor bimoleculaire reacties in nanoreactoren
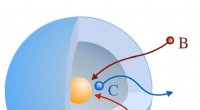
- Een fatale fout van een batterij overwinnen
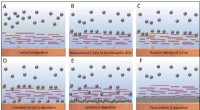
 Stroom meten met een oscilloscoop
Stroom meten met een oscilloscoop Bevorderen goede lessen de aandacht en het gedrag van leerlingen?
Bevorderen goede lessen de aandacht en het gedrag van leerlingen?  Gemeenschappen zoeken naar manieren om te leven met toenemende branddreiging
Gemeenschappen zoeken naar manieren om te leven met toenemende branddreiging Microplastics komen veel voor in huizen in 29 landen:nieuw onderzoek laat zien wie het meeste risico loopt
Microplastics komen veel voor in huizen in 29 landen:nieuw onderzoek laat zien wie het meeste risico loopt Wat is 149 graden Faherenheit in Celsius?
Wat is 149 graden Faherenheit in Celsius?  Wat is vergelijking voor versnelling?
Wat is vergelijking voor versnelling?  Een nieuwe methode om optische absorptie in halfgeleiderkristallen te meten
Een nieuwe methode om optische absorptie in halfgeleiderkristallen te meten Wetenschappers ontwikkelen nieuwe technieken om te volgen hoe cellen functioneren
Wetenschappers ontwikkelen nieuwe technieken om te volgen hoe cellen functioneren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

