
Wetenschap
Wat zou fluor moeten combineren met vorm een ionische verbinding?
Dit is waarom:
* metalen De neiging om elektronen gemakkelijk te verliezen en positief geladen ionen (kationen) te worden.
* fluor krijgt gemakkelijk een elektron om zijn buitenste schaal te voltooien en een negatief geladen ion (anion) te worden.
Deze aantrekkingskracht tussen tegengestelde ladingen resulteert in de vorming van een ionische binding, waardoor een stabiele verbinding ontstaat.
Voorbeelden:
* Natriumfluoride (NAF): Natrium (NA) verliest één elektron om Na+te worden, en fluor (F) krijgt één elektron om f- te worden. Ze combineren om NAF te vormen.
* calciumfluoride (Caf2): Calcium (CA) verliest twee elektronen om Ca2+te worden, terwijl twee fluoratomen elk één elektron krijgen om f- te worden. Ze combineren om CAF2 te vormen.
Opmerking: Fluor kan ook covalente bindingen vormen met andere niet -metalen, maar deze verbindingen worden niet beschouwd als ionisch.
 Welke persoonlijke eigenschappen hebben paleontoloog nodig?
Welke persoonlijke eigenschappen hebben paleontoloog nodig?  Waarom we oude olieplatforms in zee moeten laten, en waarom doen we dat niet?
Waarom we oude olieplatforms in zee moeten laten, en waarom doen we dat niet? Amazon-medewerkers voeren druk op klimaatkwesties op, plan staking 20 sept
Amazon-medewerkers voeren druk op klimaatkwesties op, plan staking 20 sept Wat is het deel van de aardoppervlak en atmosfeer bewoond door levende wezens?
Wat is het deel van de aardoppervlak en atmosfeer bewoond door levende wezens?  Hoe inkomen en houding de uitstoot van broeikasgassen beïnvloeden
Hoe inkomen en houding de uitstoot van broeikasgassen beïnvloeden
Hoofdlijnen
- Regenboogkleuren onthullen celgeschiedenis
- Wat betekent het woord biologische uitwisseling?
- Is entomologie de sceince van menselijke culturen?
- Twee faciliteiten werken samen voor vooruitgang in de structurele biologie met röntgenvrije-elektronenlasers en exaschaalcomputers
- Studie onderzoekt hoe poly(A)-staart-gemedieerde remodellering van maternale mRNA-controles het leven begint
- Welke kenmerken moet een levend ding worden geclassificeerd als een amfibie?
- Genetisch manipulatiemechanisme gevisualiseerd
- Gedragstherapie tegen veroudering:Onderzoekers bestuderen het effect van therapieën op oudere honden
- Hoe een dodelijke salmonellasoort zijn infectietactieken verfijnt
- Onderzoekers pleiten voor beter gebruik van chemische hulpmiddelen om biomedisch onderzoek te verbeteren
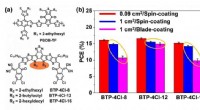
- Organische fotovoltaïsche cel met 17% efficiëntie en superieure verwerkbaarheid voor coatings op grote oppervlakken
- Wetenschappers ontwikkelen lithium-ionbatterij die niet vlam vat

- Forensische analysemethode voor lippenstiftsporen ontwikkeld

- Duidelijkste zicht ooit op celmembraan levert onverwachte structuur op, onderzoeksmogelijkheden
 Wat zijn het gebruik van amethist?
Wat zijn het gebruik van amethist?  Eiken in plaats van palmbomen? De iconische palmen van Florida snijden het niet met klimaatverandering
Eiken in plaats van palmbomen? De iconische palmen van Florida snijden het niet met klimaatverandering Azimuth berekenen
Azimuth berekenen  Wat zou er gebeuren met licht van andere sterrenstelsels als het de aarde bereikt?
Wat zou er gebeuren met licht van andere sterrenstelsels als het de aarde bereikt?  Hoeveel vloeiende ounces zit er in 1,25L?
Hoeveel vloeiende ounces zit er in 1,25L?  Wat is een vorm van demonstratie -energie die wordt getransformeerd van elektriciteit naar warmte?
Wat is een vorm van demonstratie -energie die wordt getransformeerd van elektriciteit naar warmte?  Feiten over het oude Egyptische Nijldelta-gebied
Feiten over het oude Egyptische Nijldelta-gebied  Is er tektonische plaatbeweging in New Jersey?
Is er tektonische plaatbeweging in New Jersey?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

