
Wetenschap
Wat is de pH van 0,89 M NAF?
1. Begrijp de chemie
* NAF is het zout van een zwak zuur (HF) en een sterke basis (NaOH).
* Wanneer NAF oplost in water, dissocieert het volledig in Na+ en Fies.
* Het F-ion is de conjugaatbasis van de zwakke zure HF, en het zal hydrolyse ondergaan (reactie met water) om OH-ionen te produceren, waardoor de oplossing basisch wordt.
2. Stel het hydrolyse -evenwicht in
De hydrolysereactie voor f- is:
F- (aq) + h2o (l) ⇌ hf (aq) + oh- (aq)
3. Gebruik de KB -expressie
We moeten de KB (basedissociatieconstante) vinden voor het fluoride -ion. We kunnen het berekenen met behulp van de KW (ionenproductconstante van water) en KA (zuurdissociatieconstante) voor HF:
* Kw =ka * kb
* Kb =KW / ka
De KA voor HF is 6,8 x 10^-4. KW is 1,0 x 10^-14.
* Kb =(1,0 x 10^-14) / (6,8 x 10^-4) =1,47 x 10^-11
4. Zet een ijstafel op
| | F- | HF | Oh- |
| ----- | --------- | ---------- | ----------- |
| I | 0,89 m | 0 | 0 |
| C | -x | +x | +x |
| E | 0.89-X | X | X |
5. Oplossen voor x (de hydroxideconcentratie)
Kb =[hf] [oh-] / [f-]
1,47 x 10^-11 =x * x / (0.89 - x)
Omdat KB erg klein is, kunnen we aannemen dat X te verwaarlozen is in vergelijking met 0,89:
1.47 x 10^-11 ≈ X^2 / 0.89
x^2 ≈ 1.31 x 10^-11
x ≈ 3,62 x 10^-6 m (dit is de concentratie van OH-)
6. Bereken POH en pH
* poh =-og [oh-] =-log (3,62 x 10^-6) ≈ 5.44
* pH + poh =14
* pH =14 - POH ≈ 8.56
Daarom is de pH van een 0,89 m NAF -oplossing ongeveer 8,56.
 Is ammoniakzuur basisch of neutraal?
Is ammoniakzuur basisch of neutraal?  Waarom zijn anionen groter dan het neutrale element dat ze vroeger waren?
Waarom zijn anionen groter dan het neutrale element dat ze vroeger waren?  Waarom exploderen azijn en zuiveringszout als ze met elkaar gemengd worden?
Waarom exploderen azijn en zuiveringszout als ze met elkaar gemengd worden?  Hoe passen deeltjes opgeloste stof en oplosmiddelen in elkaar?
Hoe passen deeltjes opgeloste stof en oplosmiddelen in elkaar?  Wat is een verandering met hele atomen die worden genoemd?
Wat is een verandering met hele atomen die worden genoemd?
 Wat kunnen de New Urban Agenda en Sustainable Development Goals voor steden betekenen?
Wat kunnen de New Urban Agenda en Sustainable Development Goals voor steden betekenen? Is er een boom genaamd Trash Palm?
Is er een boom genaamd Trash Palm?  Welke elementen worden niet gevonden in alle levende wezens?
Welke elementen worden niet gevonden in alle levende wezens?  Beoordeling van de impact van orkanen op de bossen van Puerto Rico
Beoordeling van de impact van orkanen op de bossen van Puerto Rico De betekenis van ruimdenkendheid in de wetenschap?
De betekenis van ruimdenkendheid in de wetenschap?
Hoofdlijnen
- Wat is de theorie van overerving dat genen zich bevinden op chromosomen die segregatie en onafhankelijk assortiment ondergaan?
- Maakt lachen jou gelukkig?
- Onderzoekers trainen een reeks AI-modellen om signalen voor geheugenvorming in de hersenen te identificeren
- Kunnen we meer levens redden als we resistente bacteriën laten leven?
- Waar wordt DNA specifiek gevonden in onze cellen?
- Hoeveel liter bloed bevat het menselijk lichaam?
- Hoe de worm weet waar zijn neus is
- Hoe zijn de hersenen van primaten zo groot geworden?
- Komt een plantengroei op bij de stengel laat bloemen en wortels achter?
- Techniek onthult diepere inzichten in de samenstelling van parelmoer, een natuurlijk materiaal
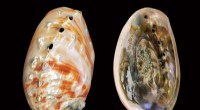
- Kunnen we kanker genezen door uit te zoeken hoe twee eiwitten op elkaar inwerken?

- Nieuwe fluorescerende kleurstoffen kunnen biologische beeldvorming bevorderen

- Nieuwe immunoassaytechniek meet extreem lage concentraties van kleine moleculen met behulp van detectie van één molecuul
- Nieuwe studie onthult ladingsoverdracht op het grensvlak van spineloxide en ceria tijdens oxidatie van koolmonoxide

 Dubbele Janus-nanodeeltjes omgezet in komvormige dynamische inclusielichamen voor colloïdontwerp
Dubbele Janus-nanodeeltjes omgezet in komvormige dynamische inclusielichamen voor colloïdontwerp Wat gebeurt er met de deeltjes van een vloeistof als deze bevriest?
Wat gebeurt er met de deeltjes van een vloeistof als deze bevriest?  Hoe theoretische H3O berekenen
Hoe theoretische H3O berekenen  Biologisch gerichte nanodeeltjes kunnen de effecten van bestralingstherapie versterken
Biologisch gerichte nanodeeltjes kunnen de effecten van bestralingstherapie versterken Wat zijn de soorten technologie in een wiskundelokaal?
Wat zijn de soorten technologie in een wiskundelokaal?  Bacteriën die giftige metalen binden:zijn zij de toekomst van het opruimen van kernafval?
Bacteriën die giftige metalen binden:zijn zij de toekomst van het opruimen van kernafval?  3D-structuur van enzym opent pad naar nieuw medicijnontwerp bij hersenziekte
3D-structuur van enzym opent pad naar nieuw medicijnontwerp bij hersenziekte De dijken van New Orleans worden zwaar op de proef gesteld terwijl de storm losbarst
De dijken van New Orleans worden zwaar op de proef gesteld terwijl de storm losbarst
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

