
Wetenschap
Wat is meer reactief fosfor of zwavel?
Redenen:
* elektronegativiteit: Fosfor heeft een hogere elektronegativiteit (2.19) dan zwavel (2.58). Dit betekent dat fosfor een grotere neiging heeft om elektronen aan te trekken, waardoor het waarschijnlijker is om deel te nemen aan chemische reacties.
* ionisatie -energie: Fosfor heeft een lagere ionisatie -energie dan zwavel. Dit betekent dat het minder energie vereist om een elektron uit een fosforatoom te verwijderen, waardoor het gemakkelijker is om positieve ionen te vormen en deel te nemen aan reacties.
* Atomaire maat: Fosfor is kleiner dan zwavel. Deze kleinere maat zorgt voor sterkere interacties met andere atomen, wat leidt tot verhoogde reactiviteit.
* Beschikbaarheid van D-orbitalen: Fosfor heeft lege D-orbitalen, die uitbreiding van zijn valentieschaal mogelijk maken. Hierdoor kan fosfor meer bindingen vormen en deelnemen aan een breder scala aan reacties.
Voorbeelden:
* Fosfor reageert gemakkelijk met zuurstof om oxiden te vormen, terwijl zwavel langzamer reageert.
* Fosfor is zeer reactief met halogenen, terwijl zwavel langzamer reageert.
* Fosfor vormt stabielere verbindingen met metalen dan zwavel.
Conclusie:
Vanwege zijn hogere elektronegativiteit, lagere ionisatie-energie, kleinere atoomgrootte en beschikbaarheid van D-orbitalen, is fosfor reactiever dan zwavel.
 We hebben geen idee hoeveel microplastic er in de bodem van Australië zit (maar het kan veel zijn)
We hebben geen idee hoeveel microplastic er in de bodem van Australië zit (maar het kan veel zijn) MBARI-ontwerp gebruikt in oceaanverzuringsexperimenten over de hele wereld
MBARI-ontwerp gebruikt in oceaanverzuringsexperimenten over de hele wereld Noordelijke veengebieden bevatten mogelijk twee keer zoveel koolstof als eerder werd gedacht
Noordelijke veengebieden bevatten mogelijk twee keer zoveel koolstof als eerder werd gedacht 100 jaar oude fruitcake tussen de artefacten van Kaap Adare
100 jaar oude fruitcake tussen de artefacten van Kaap Adare Wat de aardbevingswetenschap ons kan vertellen over de kernproef van Noord-Korea?
Wat de aardbevingswetenschap ons kan vertellen over de kernproef van Noord-Korea?
Hoofdlijnen
- Wat symboliseren voedselketens en -webben?
- Wat zijn gedeeltelijke parasieten?
- Waarom is het celmembraan belangrijk om een cel te overleven?
- In welke voedselketen past de Toucan?
- Waarom wordt micro-evolutie beweerd door creationisten en evolutiewetenschappers?
- Hoe waar mensen zijn uitgevonden?
- Supergenetica:genen die beschermen tegen COVID-19 en meer
- Nieuwe studie wijst op onverwachte voordelen van rabiësvaccinatie bij honden
- Wat en ribosomen werken samen?
- Kleine veranderingen in de structuur van oppervlakteactieve stoffen beïnvloeden het vermogen om olieachtige moleculen in te kapselen

- Onderzoekers ontwikkelen microscoop om lichtenergiestroom in fotosynthetische cellen te volgen
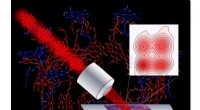
- Tumbleweeds of fibrillen:Tau-eiwitten moeten kiezen
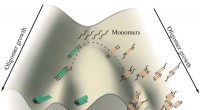
- Onderzoekers op het gebied van kerntechnologie ontwikkelen nieuwe, veerkrachtige, met oxidedispersie versterkte legering

- Onderzoekers bedenken methode om het potentieel van veelgebruikte medicijnen te ontsluiten
 Welk deel van het lichaam maakt bloed?
Welk deel van het lichaam maakt bloed?  Hoeveel is 27,6 cm in inches?
Hoeveel is 27,6 cm in inches?  Disney-winst stijgt naarmate Fox zich bij de kudde voegt
Disney-winst stijgt naarmate Fox zich bij de kudde voegt Welke vorm van energie heeft een motoroverdracht?
Welke vorm van energie heeft een motoroverdracht?  Wanneer water wordt gemengd met ontsmettingsalcohol, lossen de twee vloeistoffen volledig op. Zijn mengbaar of zijn ze niet -mengbaar?
Wanneer water wordt gemengd met ontsmettingsalcohol, lossen de twee vloeistoffen volledig op. Zijn mengbaar of zijn ze niet -mengbaar?  Wat is een manier om de mate van verzadiging te bepalen, een vaste vloeistofoplossing druppel kristal opgeloste stof in als er op de onderste container zit?
Wat is een manier om de mate van verzadiging te bepalen, een vaste vloeistofoplossing druppel kristal opgeloste stof in als er op de onderste container zit?  Fusiebrandstof voor de gek houden:hoe je onhandelbaar plasma kunt disciplineren
Fusiebrandstof voor de gek houden:hoe je onhandelbaar plasma kunt disciplineren  Wetenschappers ontwikkelen gesynchroniseerde moleculaire motoren
Wetenschappers ontwikkelen gesynchroniseerde moleculaire motoren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

