
Wetenschap
Welk element zal een edelgasconfiguratie hebben als het een ionische binding vormt door één elektron te doneren aan fluoratoom?
Dit is waarom:
* Natrium's elektronenconfiguratie: Natrium heeft een elektronenconfiguratie van 1S² 2S² 2P⁶ 3S¹. Dit betekent dat het één elektron heeft in zijn buitenste schaal (3s).
* Fluor's Electron Configuration: Fluor heeft een elektronenconfiguratie van 1S² 2S² 2P⁵. Het heeft zeven elektronen in zijn buitenste schaal (2p) en heeft nog een elektron nodig om een stabiel octet (edelgasconfiguratie) te bereiken.
* Ionische bindingsvorming: Wanneer natrium zijn enkele valentie -elektron aan fluor doneert, verliest het één negatieve lading en vormt het een positief geladen ion (NA⁺). Fluor krijgt het elektron en wordt een negatief geladen ion (F⁻).
* Nobele gasconfiguratie: Natrium heeft na het verliezen van zijn valentie -elektron een elektronenconfiguratie van 1S² 2S² 2P⁶. Dit komt overeen met de elektronenconfiguratie van Neon (NE), een edelgas.
Samenvattend: Door één elektron aan fluor te verliezen, bereikt natrium een stabiele edelgasconfiguratie en vormt een stabiele ionische binding met fluor.
 Wat is het atoomnummer van het nitrogenen en waarom?
Wat is het atoomnummer van het nitrogenen en waarom?  Nieuwe katalysator overtreft platina voor de productie van waterstof
Nieuwe katalysator overtreft platina voor de productie van waterstof Nieuwe katalysator leidt tot efficiëntere productie van butadieen
Nieuwe katalysator leidt tot efficiëntere productie van butadieen Wat is de eenvoudigste formule voor verbinding gevormd tussen fosfor en overtollig chloor?
Wat is de eenvoudigste formule voor verbinding gevormd tussen fosfor en overtollig chloor?  Elk Brønsted Lowry-zuur is ook een Lewis-zuur.?
Elk Brønsted Lowry-zuur is ook een Lewis-zuur.?
 Voordelen en nadelen van biologische controle
Voordelen en nadelen van biologische controle  Waarom is het moeilijk om een consensus te bereiken over het relatieve belang van menselijke en natuurlijke factoren bij klimatologische veranderingen?
Waarom is het moeilijk om een consensus te bereiken over het relatieve belang van menselijke en natuurlijke factoren bij klimatologische veranderingen?  Wat is een hemellichaam bestaande uit rots of metaal?
Wat is een hemellichaam bestaande uit rots of metaal?  Het redden van de Mary River-schildpad:hoe mensen van Tiaro zich achter een iconische soort schaarden
Het redden van de Mary River-schildpad:hoe mensen van Tiaro zich achter een iconische soort schaarden  Wat is het doel van een schaal?
Wat is het doel van een schaal?
Hoofdlijnen
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Hoe zou cel eruit zien als hij Android 16 absorbeert?
- Wat is de diatomee -locomotie?
- Noemen olifanten 'mensen!'?
- Hoe werken het bloedsomloop- en spijsverteringssysteem samen om voedsel te leveren, alle cellenlichaam?
- Wat is een vrije of bewegende grenselektroforese?
- Honden zijn overleden na het likken van een gewone chemotherapiecrème, waarschuwt de FDA
- Verschil in DNA tussen oudercel- en dochtermeiose?
- Het gevouwen systeem van membranen dat een met onderling verbonden compartiment van het netwerk vormt in de cel wordt aangeroepen?
- Verhoogde niveaus van goede vetten met een experimenteel medicijn dat inwerkt op twee nieuw gekarakteriseerde genen

- Chemische vrije kleuring van weefsel met behulp van deep learning
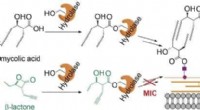
- Antibacteriële bèta-lacton infiltreert in de biosynthese van het mycomembraan en doodt de ziekteverwekker van tuberculose
- Een bacterieceljasje labelen:team bedenkt wetenschappelijke methode om cellen te volgen die betrokken zijn bij immuunziekten

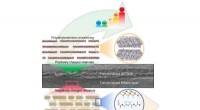
- Bionische idee stimuleert lithium-ion-extractie
 Grafeen nanolinten als elektronische schakelaars
Grafeen nanolinten als elektronische schakelaars Wat zijn de functies van de Cecum?
Wat zijn de functies van de Cecum?  Typhoon laat een dode, verpest Kerstmis in Filipijnen
Typhoon laat een dode, verpest Kerstmis in Filipijnen Wat is het aantal jaren dat een ster in hoofdreeks blijft?
Wat is het aantal jaren dat een ster in hoofdreeks blijft?  Welke vorm van energie wordt geassocieerd met de positie een object in zwaartekrachtveld?
Welke vorm van energie wordt geassocieerd met de positie een object in zwaartekrachtveld?  Moleculaire volumeregeling
Moleculaire volumeregeling Wat is het grootste deel van de negatieve lading op het watermolecuul?
Wat is het grootste deel van de negatieve lading op het watermolecuul?  Volksgezondheidsdeskundige:we moeten naar een nieuw type normaal gaan
Volksgezondheidsdeskundige:we moeten naar een nieuw type normaal gaan
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

