
Wetenschap
Wat is het grootste deel van de negatieve lading op het watermolecuul?
Dit is waarom:
* Zuurstof is elektronegatiefer dan waterstof: Zuurstof heeft een sterkere trek aan elektronen dan waterstof. Dit betekent dat de gedeelde elektronen in de O-H-obligaties meer tijd dichter bij het zuurstofatoom besteden.
* gebogen moleculaire geometrie: Het watermolecuul heeft een gebogen vorm vanwege de twee eenzame paren elektronen op het zuurstofatoom. Deze gebogen vorm concentreert de negatieve lading verder rond de zuurstof.
Als gevolg hiervan draagt het zuurstofatoom in water een gedeeltelijke negatieve lading (Δ-), terwijl de waterstofatomen een gedeeltelijke positieve lading (δ+) dragen. Dit creëert een polair molecuul met een dipoolmoment.
 Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen
Veranderende eetgewoonten om klimaatverandering aan te pakken onbereikbaar voor minderheidsgroepen NASA-satelliet ziet een grote orkaan Lorenzo op weg naar de Azoren
NASA-satelliet ziet een grote orkaan Lorenzo op weg naar de Azoren De schakelaar omdraaien:gebruik maken van koolstofprijsdollars voor gezondheid en onderwijs
De schakelaar omdraaien:gebruik maken van koolstofprijsdollars voor gezondheid en onderwijs Waarom is dichtheid een belangrijke eigenschap van materie, leg op zijn minst twee manieren uit waarop dit praktisch belang heeft?
Waarom is dichtheid een belangrijke eigenschap van materie, leg op zijn minst twee manieren uit waarop dit praktisch belang heeft?  Ontdekking van sediment ontsluit het verborgen netto-nulpotentieel van Australië
Ontdekking van sediment ontsluit het verborgen netto-nulpotentieel van Australië
Hoofdlijnen
- Biologen onthullen hoe obesitas het skeletspiermetabolisme schaadt
- Het proces waarbij twee of meer atoomkernen samenkomen om één enkele kern te vormen, wordt genoemd?
- Biology Speech Topics
- Welk macromolecuul vormt een enzym?
- Vrijgelaten zeeschildpad draagt as van oceanografen naar zee
- Verschil tussen triglyceriden en fosfolipiden
- Wat zijn twee soorten informatie die wetenschappers proberen af te leiden uit de studiefossielen?
- Onderzoek benadrukt pathoblokkers als toekomstig alternatief voor antibiotica
- Nieuw onderzoek identificeert een gebrek aan geschikte bestrijdingsmiddelen voor veel belangrijke infectieziekten bij dieren
- Kracht voor de toekomst met revolutionaire lithiumextractietechniek
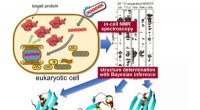
- In-situ meting van 3D-eiwitstructuur in levende eukaryote cellen
- Mobiel apparaat kan het gemakkelijker maken om schadelijke algenbloei te voorspellen en te beheersen

- Ultrasone trillingen dwingen een polymeer om een halfgeleider te zijn
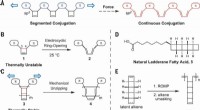
- De sleutel tot het verminderen van de uitstoot van kooldioxide is gemaakt van metaal

 Pijpleiding ontspoord, zo is de klimaatstrategie van Canada
Pijpleiding ontspoord, zo is de klimaatstrategie van Canada Is de chemie betrokken bij toneelverlichting?
Is de chemie betrokken bij toneelverlichting?  Facebook-gebruik neemt af in de VS omdat sociale media onder druk staan
Facebook-gebruik neemt af in de VS omdat sociale media onder druk staan Cryo-EM onthult kroonachtige structuur van eiwit dat verantwoordelijk is voor het reguleren van de bloedstroom
Cryo-EM onthult kroonachtige structuur van eiwit dat verantwoordelijk is voor het reguleren van de bloedstroom Wereldwaterdag 2020:ontziltingstechnologieën zorgen voor veilig en duurzaam drinkwater
Wereldwaterdag 2020:ontziltingstechnologieën zorgen voor veilig en duurzaam drinkwater Onderzoekers ontdekken wat sommige kippen waterefficiënter maakt dan andere
Onderzoekers ontdekken wat sommige kippen waterefficiënter maakt dan andere  Welke betekenis heeft de lente-equinox in de astrologie?
Welke betekenis heeft de lente-equinox in de astrologie?  SDO ziet een nieuw soort magnetische explosie op de zon
SDO ziet een nieuw soort magnetische explosie op de zon
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

