
Wetenschap
Nieuwe katalysator overtreft platina voor de productie van waterstof

Krediet:CC0 Publiek Domein
Waterstof, het meest voorkomende element in het universum, geeft een krachtige stoot. En omdat het geen koolstof bevat, het produceert alleen water wanneer het als brandstof wordt gebruikt. Maar op aarde, waterstof bestaat meestal in combinatie met andere elementen, wat betekent dat het moet worden geëxtraheerd.
Om de schone kracht van waterstof te benutten voor energietoepassingen en andere toepassingen, onderzoekers kijken naar betaalbare manieren om waterstof te produceren en op te slaan.
Nieuw onderzoek van Pacific Northwest National Laboratory (PNNL) toont aan dat een combinatie van nederige mineralen andere edele metalen materialen overtreft als het gaat om de productie van waterstof. Met medewerkers van de Oregon State University (OSU), de onderzoekers testten een molybdeen-fosfide (MoP) katalysator met afvalwater in een kleine reactor die een microbiële elektrolysecel (MEC) wordt genoemd. Testresultaten toonden aan dat MoP beter werkte dan platina, een kostbaar en duur metaal dat doorgaans wordt gebruikt vanwege zijn hoge katalytische prestaties. De MoP-katalysator produceerde ook vijf keer zo snel waterstof als andere niet-platina-katalysatoren die in verwante onderzoeken zijn gerapporteerd.
Maar de echte kicker? Hun katalysator werkte ook goed met zeewater.
"Als je waterstof kunt maken uit zeewater, de resource pool is vrijwel onbeperkt, " zei Yuyan Shao, een materiaalwetenschapper bij PNNL die het katalysatoronderzoek leidde.
zoals zeewater, het MoP-katalysatormateriaal is overal verkrijgbaar, en daarom, goedkoop. De katalysator werkte ook met afvalwater, een andere alomtegenwoordige bron.
Details van de studie van het team verschijnen in het tijdschrift ACS Katalyse . De bevindingen komen voort uit een driejarig project gefinancierd door het Fuel Cell Technologies Office van het Department of Energy.
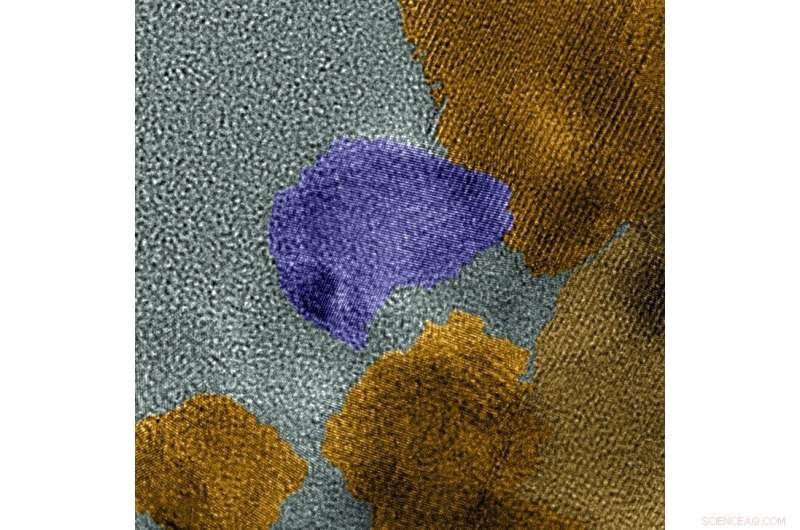
Dit ingekleurde TEM-microscoopbeeld met hoge resolutie toont de twee fasen van de katalysator, MoP in paars, MoP2 in geel. Krediet:laboratorium voor milieu-moleculaire wetenschappen
Een beter alternatief
Een van de meest gebruikelijke methoden voor het produceren van waterstof is een proces dat elektrolyse wordt genoemd. Dit proces combineert elektriciteit met verschillende chemicaliën, elektrolyten genoemd, en een vast katalysatormateriaal. De daaropvolgende reactie produceert waterstof, maar het hele proces kost veel energie en kostbare bronnen zoals platina.
Vergisting met behulp van hernieuwbare bronnen of afvalstromen belooft een betaalbare waterstofproductie. Maar het fermentatieproces werkt langzaam, de opbrengsten zijn laag, en de productstroom vereist dure schoonmaak vanwege andere bijproducten van fermentatie. In MEC's, een elektrische stroom wordt gekoppeld aan bacteriën om organische stoffen af te breken en waterstof te maken. Helaas, de cellen gebruiken ook kostbaar platina voor het reactieoppervlak, en als niet-platinakatalysatoren worden gebruikt, waterstofopbrengsten blijven laag.
Bij OSU, onderzoekers ontwikkelden een hybride MEC-ontwerp waarin fermentatie en elektrolyse plaatsvinden in een enkele pot in plaats van afzonderlijke stappen, en de bijproducten worden direct geconsumeerd in het proces. Dit geïntegreerde ontwerp verhoogt de productiviteit en verlaagt de apparatuurkosten. Maar met de hoge kosten van platina, het team had een katalysator nodig die de productiekosten kon verlagen tot ongeveer twee dollar per kilogram waterstof.
Tweede fase verrassing
Voortbouwend op eerdere ontdekkingen met de MoP-katalysator, Onderzoekers van PNNL onderzochten de katalysator voor gebruik in MEC's. Het onderzoeksteam begon met de MoP-combinatie vanwege de affiniteit voor het activeren, of scheiden, water moleculen. De katalysator is ook afstembaar - de hoeveelheid van elk mineraal kan worden aangepast. Volgens de hypothese van het team, deze afstemming zou de hoeveelheid waterstof die in een enkele reactie wordt geproduceerd optimaliseren.
Ze hadden deels gelijk.
Onder een krachtige microscoop, ze ontdekten dat de katalysator samengevoegd tot een mengsel van twee verschillende kristalfasen - MoP en MoP 2 . De atomaire structuur voor elke fase was anders, leiden tot verschillende reacties. Terwijl MoP2 waterstofatomen vrijmaakte uit de watermoleculen, MoP zette de waterstofatomen om in waterstofgasmoleculen. De twee actieve sites versterkten de algehele reactie.
"We hadden de gelijktijdige vorming van de twee kristalfasen niet verwacht, "zei Shao. "De twee fasen werken veel beter dan de enkele fase."
De onderzoekers voerden hun experimenten uit onder neutrale pH-omstandigheden in zowel de hybride cel bij OSU met afvalwater als in een andere reactor bij PNNL met behulp van zeewater. met consistente resultaten. Shao zei dat deze bevindingen de onderzoekers het vertrouwen geven dat de methode degelijk is, elimineert platina en andere bijproducten, en houdt een grote belofte in voor het bevorderen van waterstof- en brandstofceltechnologieën.
 Opslag van thermische energie:materiaal absorbeert warmte als het smelt en geeft het weer af als het stolt
Opslag van thermische energie:materiaal absorbeert warmte als het smelt en geeft het weer af als het stolt Nieuwe biotechtechniek versnelt onderzoek naar eiwittherapie
Nieuwe biotechtechniek versnelt onderzoek naar eiwittherapie Zure regeneffecten op planten en dieren
Zure regeneffecten op planten en dieren Een nieuwe benadering voor het versterken van DNA
Een nieuwe benadering voor het versterken van DNA Poreuze polymeren vertonen opmerkelijke stabiliteit bij hoge druk
Poreuze polymeren vertonen opmerkelijke stabiliteit bij hoge druk
 Afbeelding:verwoestende Kincaid-brand in Californië blijft zich verspreiden
Afbeelding:verwoestende Kincaid-brand in Californië blijft zich verspreiden India zegt dat Chinese constructie op rivier het water vervuilt
India zegt dat Chinese constructie op rivier het water vervuilt Oude overstromingen gevormd, achtergelaten rotsblokken in Wildcat Ridge
Oude overstromingen gevormd, achtergelaten rotsblokken in Wildcat Ridge Kijk eerst naar een duurzame landbouwmulch
Kijk eerst naar een duurzame landbouwmulch Alternatieven voor verbranding kunnen de winst van Indiase boeren verhogen en de vervuiling verminderen
Alternatieven voor verbranding kunnen de winst van Indiase boeren verhogen en de vervuiling verminderen
Hoofdlijnen
- Hoe virtuele geneeskunde werkt
- Graafwespen en hun chemie
- Wat zijn stamcellen en waarvoor worden ze gebruikt?
- De beste manieren om bacteriën te kweken op agar
- Wat zijn de functies van microfilamenten en microtubuli?
- Wat als Homeostase mislukt?
- Maaien of niet maaien:Overlastgroei van waterplanten bij de wortel aanpakken
- Wat is het Genotype voor de Roan-kleur?
- Metrowerk in Los Angeles onthult een reeks fossielen uit de ijstijd (update)
- Onderzoekers vinden waarde in ongebruikelijk type plantmateriaal

- Ingenieurs ontwikkelen botachtig metaalschuim dat bij kamertemperatuur kan worden genezen

- Diepblauwe organische lichtemitterende diodes op basis van een doublet-emissie cerium(III)-complex
- Microgelmysteries ontrafelen

- Een nummer van het pipe-schema berekenen

 Nepfoto gepakt via slimme technieken
Nepfoto gepakt via slimme technieken Debat:collectieve intelligentie mobiliseren voor de ecologische transitie
Debat:collectieve intelligentie mobiliseren voor de ecologische transitie Activiteiten voor medische terminologie
Activiteiten voor medische terminologie  Automatisch experimenten sturen naar wetenschappelijke ontdekkingen
Automatisch experimenten sturen naar wetenschappelijke ontdekkingen Hoe gemeenschapsstructuur de veerkracht van een netwerk beïnvloedt
Hoe gemeenschapsstructuur de veerkracht van een netwerk beïnvloedt Technologieën voor het mobiele netwerk van de zesde generatie
Technologieën voor het mobiele netwerk van de zesde generatie NIST:Blockchain biedt beveiliging, traceerbaarheid voor slimme productie
NIST:Blockchain biedt beveiliging, traceerbaarheid voor slimme productie Wat is de afstand van Saturnus tot de zon?
Wat is de afstand van Saturnus tot de zon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway | French |

-
Wetenschap © https://nl.scienceaq.com

