
Wetenschap
Elektronenconfiguratie voor fluor in de opgewonden toestand?
1. Grondstatusconfiguratie
* Fluor (F) heeft een atoomnummer van 9, wat betekent dat het 9 elektronen heeft.
* De elektronenconfiguratie van de grondtoestand is: 1S² 2S² 2P⁵
2. Opgewonden toestand
* In een opgewonden toestand worden een of meer elektronen gepromoveerd tot hogere energieniveaus.
* De meest waarschijnlijke excitatie voor fluor omvat het promoten van een van de 2P -elektronen tot de 3s orbital.
3. Opgewonden statusconfiguratie
* De geëxciteerde statusconfiguratie zou zijn: 1S² 2S² 2P⁴ 3S¹
belangrijke opmerkingen:
* Er zijn andere mogelijke geëxciteerde statusconfiguraties, maar dit is de meest waarschijnlijke en energetisch gunstige.
* Geëxciteerde toestanden zijn tijdelijk en de elektronen zullen uiteindelijk terugkeren naar hun grondtoestand, waardoor energie wordt vrijgeeft (vaak als licht).
 Verborgen oorzaak van lage energie-efficiëntie van lithiumrijke kathodematerialen onthuld
Verborgen oorzaak van lage energie-efficiëntie van lithiumrijke kathodematerialen onthuld  Waarom zijn gassen betere isolatoren dan vloeistoffen?
Waarom zijn gassen betere isolatoren dan vloeistoffen?  Hoeveel liter salpeterzuur zit er in 35 kg?
Hoeveel liter salpeterzuur zit er in 35 kg?  Wat is de vergelijking voor verbranding van fossiele brandstoffen?
Wat is de vergelijking voor verbranding van fossiele brandstoffen?  Is het gedistilleerd waterelementverbinding of het mengsel?
Is het gedistilleerd waterelementverbinding of het mengsel?
 Waarom sommige paren op elkaar lijken
Waarom sommige paren op elkaar lijken  Vier basiscomponenten van een ecosysteem
Vier basiscomponenten van een ecosysteem  Nieuw onderzoek laat in realtime zien wat zoogdieren helpt een natuurramp te overleven
Nieuw onderzoek laat in realtime zien wat zoogdieren helpt een natuurramp te overleven  Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid
Nieuw onderzoek laat zien hoe meer boeren kunnen worden betrokken bij het ontwerpen van nieuw milieubeleid  Wat als iedereen op aarde dezelfde taal sprak?
Wat als iedereen op aarde dezelfde taal sprak?
Hoofdlijnen
- Waarom gedijt dit invasieve, niet-inheemse rietgras in de wetlands?
- Uitbreiding van Braziliaans suikerriet kan de wereldwijde CO2-uitstoot verminderen
- Hoeveel basen bevat een enkel menselijk chromosoom?
- Hoe kunnen vogels en honden beide instructies in DNA gebruiken om functie te laten groeien, nog steeds verschillende organismen zijn?
- Welke twee organellen produceren lipiden?
- Facebook en Apple zijn het er niet over eens hoe ze nepnieuws tijdens de midterms moeten beteugelen
- Voedselketen: definitie, soorten, belang en voorbeelden (met diagram)
- Een Chromosome-diagram interpreteren
- Wat betekent geldig in wetenschappelijke termen?
- Video:vijf dingen die je misschien niet wilt combineren met anticonceptie

- enzymen nabootsen, scheikundigen produceren grote, nuttige koolstofringen
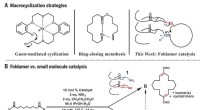
- Sommigen houden van cryogeen

- Hoe de petro uit de petrochemische industrie te halen?

- Engineered C. glutamicum-stam die in staat is glutaarzuur op hoog niveau te produceren uit glucose
 Hoe energie verandert zijn vormen?
Hoe energie verandert zijn vormen?  Waar publiceren wetenschappers hun resultaten?
Waar publiceren wetenschappers hun resultaten?  Geen water meer onder de brug, statistiek levert nieuwe gegevens over zeeniveau op
Geen water meer onder de brug, statistiek levert nieuwe gegevens over zeeniveau op Yoga broek, knusse kleding kan de belangrijkste bron van zeevervuiling zijn
Yoga broek, knusse kleding kan de belangrijkste bron van zeevervuiling zijn Wat is de wetenschappelijke naam voor eierschaal?
Wat is de wetenschappelijke naam voor eierschaal?  Wat zijn wonderen van wetenschap?
Wat zijn wonderen van wetenschap?  Wat zijn energieconversies in een oven?
Wat zijn energieconversies in een oven?  Werelderfgoedlocaties worden gehamerd door menselijke activiteiten
Werelderfgoedlocaties worden gehamerd door menselijke activiteiten
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

