
Wetenschap
Wanneer zink reageert met sulfuirczuur Welke waterstofmassa wordt geproduceerd uit 31,8 g zink?
1. Schrijf de gebalanceerde chemische vergelijking:
Zn (s) + h₂so₄ (aq) → ZnSo₄ (aq) + h₂ (g)
2. Bepaal de molaire massa van zink (Zn):
De molaire massa Zn is 65,38 g/mol.
3. Bereken mol zink:
* Mol Zn =(massa Zn) / (molaire massa van Zn)
* Mol Zn =31,8 g / 65,38 g / mol
* Mol Zn ≈ 0,487 mol
4. Pas de molverhouding toe:
* Uit de evenwichtige vergelijking produceert 1 mol Zn 1 mol H₂.
5. Bereken mol waterstof (H₂):
* Mol h₂ =mol Zn
* Mol h₂ ≈ 0,487 mol
6. Bepaal de molaire waterstofmassa (H₂):
* De molaire massa van H₂ is 2.016 g/mol.
7. Bereken de massa waterstof:
* Massa van H₂ =(mol h₂) * (molaire massa van h₂)
* Massa van H₂ ≈ 0,487 mol * 2.016 g/mol
* Massa van H₂ ≈ 0,982 g
Daarom worden ongeveer 0,982 gram waterstof geproduceerd uit 31,8 gram zink.
 Wat is carbonaatbuffering?
Wat is carbonaatbuffering?
Veel van de meest herkenbare delen van de natuur functioneren door een of andere balans te handhaven. Het carbonaatbuffersysteem is een van de belangrijkste buffersystemen in de natuur, wat helpt om dat evenwicht te handh
 Waarom maken zuren en basen goede elektrische geleiders wanneer ze in water worden opgelost?
Waarom maken zuren en basen goede elektrische geleiders wanneer ze in water worden opgelost?  Is koper een monoatomisch moleculair of roosterelement?
Is koper een monoatomisch moleculair of roosterelement?  Wat zijn de opgeloste stof en het oplosmiddel van een alcohol?
Wat zijn de opgeloste stof en het oplosmiddel van een alcohol?  Welk gas dat de ozonlaag beschadigt?
Welk gas dat de ozonlaag beschadigt?
 Unieke gegevens bevestigen waarom water bruin wordt
Unieke gegevens bevestigen waarom water bruin wordt Sponsbacterie gevonden om arseen in te kapselen uit de omgeving
Sponsbacterie gevonden om arseen in te kapselen uit de omgeving Wat is een bepaalde rol in een ecosysteem of hoe het zijn leven verdient?
Wat is een bepaalde rol in een ecosysteem of hoe het zijn leven verdient?  Indiase zomermoesson versterkte opwarming van de aarde 130, 000 jaar geleden, helpen een einde te maken aan de ijstijd
Indiase zomermoesson versterkte opwarming van de aarde 130, 000 jaar geleden, helpen een einde te maken aan de ijstijd Over de dennenboom Caterpillar
Over de dennenboom Caterpillar
Hoofdlijnen
- Chimpansees brengen insecten aan op wonden, een mogelijk geval van medicijngebruik?
- Wat is een irisdiafragma in een microscoop?
- Wat is een andere naam voor dorsaal?
- Onderzoekers maken een 3D-model van het ribosoom en visualiseren hoe het is gemaakt
- Hoe grassen zoals tarwe in de kou kunnen groeien
- Wat is de naam Dolly om te worden geassocieerd met een nieuwe tak van de wetenschap?
- De oorsprong van genen voor het maken van bloemen
- Onderwaterhitte inferno verwoest mediterrane koralen
- Sauropod-zwemmers of wandelaars?
- Geheim van Britse chocoladeproductie inspireert ontdekking van nieuwe lactosevorm

- Het bedekken van metalen katalysatoroppervlakken met dunne tweedimensionale oxidematerialen kan chemische reacties versterken
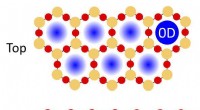
- Een stap in de richting van metaal-organische raamwerksynthese
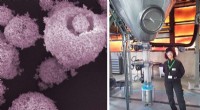
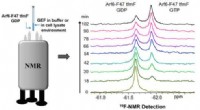
- Snelle methode helpt bij het detecteren van Arf6-guanine-nucleotide-uitwisselingsfactoractiviteit
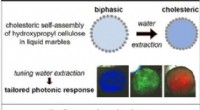
- Zelfassemblage van responsieve fotonische biobased materialen in vloeibare knikkers
 Hoe wordt potentiële energie bepaald?
Hoe wordt potentiële energie bepaald?  Waar komen de ingrediënten in dat broodje vandaan? Onze wereldwijde nutriëntentracker vertelt een complex verhaal
Waar komen de ingrediënten in dat broodje vandaan? Onze wereldwijde nutriëntentracker vertelt een complex verhaal  Businessgroepen die alleen voor vrouwen zijn, marginaliseren en slagen er niet in om leden mondiger te maken
Businessgroepen die alleen voor vrouwen zijn, marginaliseren en slagen er niet in om leden mondiger te maken Wat voor soort verwering is het als planten wortels groeien in de scheuren rots?
Wat voor soort verwering is het als planten wortels groeien in de scheuren rots?  Waar zijn de minst reactieve metalen gevonden op het periodiek systeem?
Waar zijn de minst reactieve metalen gevonden op het periodiek systeem?  Onderzoekers meten de mechanica van kankercellen bij levende dieren met behulp van nanodeeltjes
Onderzoekers meten de mechanica van kankercellen bij levende dieren met behulp van nanodeeltjes Overdracht van warmte -energie rond de aarde door ongelijke verwarming wordt het oppervlak bereikt door blanco luchtpatroon?
Overdracht van warmte -energie rond de aarde door ongelijke verwarming wordt het oppervlak bereikt door blanco luchtpatroon?  Big Data maakt betere stedelijke vervoersnetwerken mogelijk
Big Data maakt betere stedelijke vervoersnetwerken mogelijk
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

