
Wetenschap
Met welke eigenschappen van koolstof kan het zoveel verbindingen vormen?
1. Tetravalentie: Koolstof heeft vier valentie -elektronen, wat betekent dat het vier covalente bindingen met andere atomen kan vormen. Dit zorgt voor een breed scala aan bindingsmogelijkheden en structurele regelingen.
2. Catentation: Koolstofatomen binden gemakkelijk aan andere koolstofatomen, die lange ketens, vertakte ketens en zelfs ringen vormen. Dit vermogen om te koppelen is cruciaal voor de vorming van complexe moleculen.
3. Mogelijkheid om enkele, dubbele en drievoudige bindingen te vormen: Koolstof kan enkele, dubbele en drievoudige bindingen vormen met andere atomen, waaronder zichzelf. Deze veelzijdigheid breidt de mogelijke moleculaire structuren en functionaliteiten verder uit.
4. Mogelijkheid om zowel lineaire als vertakte structuren te vormen: Koolstofketens kunnen lineair, vertakt of cyclisch zijn, waardoor een enorme structurele diversiteit mogelijk is.
5. Mogelijkheid om te binden met een breed scala aan elementen: Koolstof kan binden met een breed scala aan elementen, waaronder waterstof, zuurstof, stikstof, zwavel, fosfor en halogenen. Deze brede bindingsmogelijkheid zorgt voor een breed scala aan functionele groepen en diverse chemische eigenschappen.
6. Stabiliteit van koolstof-koolstofbindingen: De koolstof-koolstofbinding is relatief sterk en stabiel, wat bijdraagt aan de robuustheid van organische moleculen.
7. Isomerisme: Dezelfde moleculaire formule kan vaak aanleiding geven tot verschillende structuren (isomeren), elk met unieke eigenschappen. Dit draagt bij aan de uitgestrektheid van de mogelijke organische verbindingen.
8. Chiraliteit: Veel koolstofverbindingen vertonen chiraliteit, wat betekent dat ze bestaan als niet-superimposeerbare spiegelbeelden (enantiomeren). Dit voegt verdere complexiteit en diversiteit toe aan de chemische wereld.
Deze eigenschappen, gecombineerd, laten koolstof een ongelooflijk divers scala van organische verbindingen vormen met een verbazingwekkende reeks structuren, eigenschappen en functionaliteiten. Dit maakt koolstof de hoeksteen van het leven op aarde en de basis van organische chemie.
 Wat is coëfficiënten na plus Cl2 - NaCl?
Wat is coëfficiënten na plus Cl2 - NaCl?  Wat zijn voorbeelden van zuurstof?
Wat zijn voorbeelden van zuurstof?  Onderzoekers gebruiken een synthetische tong om whisky's te sorteren
Onderzoekers gebruiken een synthetische tong om whisky's te sorteren Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen
Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen  Welk type getal na een chemisch symbool vertelt hoeveel atomen dat element er in één molecuul zijn?
Welk type getal na een chemisch symbool vertelt hoeveel atomen dat element er in één molecuul zijn?
 Frans-Amerikaanse man geeft poging om te zwemmen in de Stille Oceaan op
Frans-Amerikaanse man geeft poging om te zwemmen in de Stille Oceaan op Selecteer de functies planten en dieren die kenmerkend zijn voor naaldbosbioom?
Selecteer de functies planten en dieren die kenmerkend zijn voor naaldbosbioom?  Tropische bergrivieren zijn waar de magie gebeurt
Tropische bergrivieren zijn waar de magie gebeurt Beheer van meanderende waterwegen in een veranderende wereld
Beheer van meanderende waterwegen in een veranderende wereld  NASA ziet Sergios-regens het zuidwesten van de VS binnenstromen
NASA ziet Sergios-regens het zuidwesten van de VS binnenstromen
Hoofdlijnen
- Welke cellen produceren antilichamen en vernietigen pathogenen?
- Welke structuur van een dierencel heeft het grootste volume?
- Welk type RNA kopieert DNA -instructies op de kern?
- De symbolische aap? Door tokens gemedieerde economische keuzes in getufte kapucijnen
- Hoe een onbekende bacterie te identificeren in de microbiologie
- Wat zijn de 3 ideeën van de celtheorie?
- Wat is een basisbestanddeel van eiwitten?
- Wat worden cellen genoemd aan het einde van meiose en genetisch geroepen?
- Honderden dode zeeschildpadden gevonden drijvend voor El Salvador
- Superresolutiemicroscopie:nog dichter bij de limiet komen

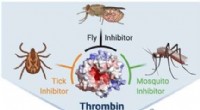
- Krachtige trivalente remmers van trombine uit antistollingspeptiden in speeksel van insecten
- Een snelle malariatestkit die de diagnose in ontwikkelingslanden kan helpen

- Nieuwe software om waardevolle verbindingen te ontdekken

- Waarom bio-elektroden voor energieconversie niet stabiel zijn

 Veldonderzoek laat zien waarom de voedselkwaliteit zal lijden onder de stijgende CO2-uitstoot
Veldonderzoek laat zien waarom de voedselkwaliteit zal lijden onder de stijgende CO2-uitstoot  Welk type energietransformatie is betrokken bij een match die wordt geslagen en verlicht?
Welk type energietransformatie is betrokken bij een match die wordt geslagen en verlicht?  Kenmerken van zaadloze vaatplanten
Kenmerken van zaadloze vaatplanten  Wiskundige activiteiten voor kinesthetische studenten
Wiskundige activiteiten voor kinesthetische studenten Kwetsbarere mannelijke volwassenen zijn slachtoffer van gedwongen huwelijken dan eerder werd gedacht
Kwetsbarere mannelijke volwassenen zijn slachtoffer van gedwongen huwelijken dan eerder werd gedacht Een voorbeeld van een krachtvermenigvuldiger?
Een voorbeeld van een krachtvermenigvuldiger?  Welke sedimentaire rotsen worden gevormd uit de overblijfselen van planten en dieren?
Welke sedimentaire rotsen worden gevormd uit de overblijfselen van planten en dieren?  Wanneer was de laatste vulkaanuitbarsting in het Verenigd Koninkrijk?
Wanneer was de laatste vulkaanuitbarsting in het Verenigd Koninkrijk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

