Wetenschap
Wat is de intermoleculaire binding van broomchloride?
Dit is waarom:
* elektronegativiteit: Chloor is elektronegatiefer dan broom, wat betekent dat het elektronen sterker aantrekt. Dit creëert een gedeeltelijke negatieve lading (Δ-) op het chlooratoom en een gedeeltelijke positieve lading (δ+) op het broomatoom.
* Dipole-dipole interactie: Het gedeeltelijke positieve uiteinde van het ene BRCL -molecuul wordt aangetrokken door het gedeeltelijke negatieve uiteinde van een ander BRCL -molecuul. Deze attracties zijn zwakker dan covalente bindingen, maar nog steeds belangrijk in het beïnvloeden van de fysische eigenschappen van BRCL.
Hoewel dispersiekrachten ook bestaan tussen alle moleculen, zijn ze zwakker dan dipool-dipoolkrachten in BRCL vanwege de significante polariteit.
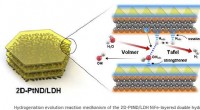
 Samenwerking leidt tot ontdekking van 2D-polymeer
Samenwerking leidt tot ontdekking van 2D-polymeer Luchtdruk wordt lowet naarmate watermoleculen zijn aan de lucht omdat moleculen?
Luchtdruk wordt lowet naarmate watermoleculen zijn aan de lucht omdat moleculen?  Waarom zijn er twee chlooratomen voor elk magnesiumatoom?
Waarom zijn er twee chlooratomen voor elk magnesiumatoom?  Chemici ontwikkelen een nieuwe methode om gefluoreerde componenten in moleculen te introduceren
Chemici ontwikkelen een nieuwe methode om gefluoreerde componenten in moleculen te introduceren  Wat is de elektronenconfiguratie voor een neutraal atoom van beryllium?
Wat is de elektronenconfiguratie voor een neutraal atoom van beryllium?
 Een uitdrogende Saltonzee:Onderzoek wijst uit dat er meer deeltjesvervuiling is nadat water naar San Diego is omgeleid
Een uitdrogende Saltonzee:Onderzoek wijst uit dat er meer deeltjesvervuiling is nadat water naar San Diego is omgeleid  Er is een grot in de vorm van een neushoorn in de staat Washington
Er is een grot in de vorm van een neushoorn in de staat Washington  Wat zegt een aanhoudende bloei van algen over de gezondheid van de planeet?
Wat zegt een aanhoudende bloei van algen over de gezondheid van de planeet? Een harde regen in Australië met klimaatverandering
Een harde regen in Australië met klimaatverandering Wetenschappers hebben enorme aantallen illegale spookwegen ontdekt die worden gebruikt om ongerept regenwoud open te breken
Wetenschappers hebben enorme aantallen illegale spookwegen ontdekt die worden gebruikt om ongerept regenwoud open te breken
Hoofdlijnen
- Groter en levensechter:wat is de toekomst van bioprinted organen?
- Zijn biologische gewassen net zo productief als conventioneel?
- Welk type cellulaire ademhaling treedt op met zuurstof?
- Wat is ventilatie in de menselijke biologie?
- Wat is het verschil tussen een cel en weefsel?
- Waarom zijn bacteriën belangrijk voor de stikstofcyclus?
- Waarom is het belangrijk dat het DNA vóór de celdeling wordt gedupliceerd?
- Onderzoek toont aan dat planten het gebruik van corrigerende Tipp-Ex-eiwitten beperken
- Wat is de functie van slijm in zowel de luchtwegen als het maagdarmkanaal?
 Welk tip van land lijdt het meest van winderosie?
Welk tip van land lijdt het meest van winderosie?  Onderzoekers stellen een nieuwe strategie voor om de efficiëntie van nanotherapeutische toediening in tumoren te verbeteren
Onderzoekers stellen een nieuwe strategie voor om de efficiëntie van nanotherapeutische toediening in tumoren te verbeteren  Hoe creëert variëteit binnen de lithosfeer onder biomen?
Hoe creëert variëteit binnen de lithosfeer onder biomen?  Perfecte stormen:orkanen en tyfoons
Perfecte stormen:orkanen en tyfoons Welke van de twee objecten verplaatst de zon of Jupiter het meest deze zwaartekracht en waarom?
Welke van de twee objecten verplaatst de zon of Jupiter het meest deze zwaartekracht en waarom?  Wat is er gebeurd met de intensiteit van zonne -energie naarmate de breedtegraad toeneemt?
Wat is er gebeurd met de intensiteit van zonne -energie naarmate de breedtegraad toeneemt?  Wat zijn de belangrijkste sterren in Orion?
Wat zijn de belangrijkste sterren in Orion?  Hoe kunt u topografische kaarten van uw regio gebruiken om te helpen beslissen over de beste locatie voor ZOO?
Hoe kunt u topografische kaarten van uw regio gebruiken om te helpen beslissen over de beste locatie voor ZOO?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com