
Wetenschap
Waarom zijn er twee chlooratomen voor elk magnesiumatoom?
Hier is een uitsplitsing:
* magnesium (mg) bevindt zich in groep 2 van de periodiek systeem, wat betekent dat het 2 valentie -elektronen heeft (elektronen in de buitenste schaal). Het verliest gemakkelijk deze twee elektronen om een stabiele, volledige buitenste schaal te bereiken en wordt een magnesiumion (mg²⁺) met een +2 lading.
* chloor (Cl) is in groep 17 van het periodiek systeem, wat betekent dat het 7 valentie -elektronen heeft. Het heeft nog een elektron nodig om een stabiele, volledige buitenste schaal te bereiken. Het krijgt een elektron om een chloride -ion (CL⁻) te worden met een -1 lading.
Om elektrische neutraliteit te bereiken (waarbij de positieve en negatieve ladingen balans is), twee chloride -ionen (2 x -1 =-2) zijn vereist om de +2 lading van het magnesiumionen in evenwicht te brengen.
Dit vormt de ionische verbinding mgcl₂ , waarbij de sterke elektrostatische aantrekkingskracht tussen de tegengesteld geladen ionen de verbinding bij elkaar houdt.
 Conservatie-ecologen stellen een reeks richtlijnen op voor de manier waarop de-extinctie ecologisch verantwoorder kan worden gemaakt
Conservatie-ecologen stellen een reeks richtlijnen op voor de manier waarop de-extinctie ecologisch verantwoorder kan worden gemaakt  Wat is een uniek kenmerk van het tropische regenwoud?
Wat is een uniek kenmerk van het tropische regenwoud?  Wetenschappers bepalen bron van grootste modderuitbarsting ter wereld
Wetenschappers bepalen bron van grootste modderuitbarsting ter wereld Heeft de invloed van koude op de invloed van objecten op metaal?
Heeft de invloed van koude op de invloed van objecten op metaal?  Herbebossingsplannen in Afrika kunnen mis gaan
Herbebossingsplannen in Afrika kunnen mis gaan
Hoofdlijnen
- Wat is een diatomische reactie?
- Wat zijn de functies van Triglyceride Phospholipid & Sterol?
- Zullen cellen in het menselijk lichaam bevriezen?
- Aardbeienvelden versterkt:nieuwe genetische inzichten bestrijden verwoestende door de bodem overgedragen ziekten
- Was de grote omvang van de sauropode dinosaurussen te danken aan plantaardig voedsel? Wetenschappers beweren dat het oude idee nog steeds benen heeft
- Nieuw onderzoek toont aan dat micro-evolutie kan worden gebruikt om te voorspellen hoe evolutie op veel langere tijdschalen werkt
- Wat voor soort organismen leven in koraalriffen en hoe hebben ze zich aangepast?
- Hoe regelt de celmembraanbeweging van materialen in en uit cel?
- Wat is de cytoskeletstructuur die chromosoom uit elkaar trekt?
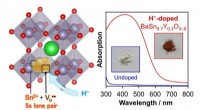
- Succesvolle synthese van perovskiet zichtbaar lichtabsorberend halfgeleidermateriaal
- SpaceMat:Graphenes antwoord op de lancering van rubber voor recycling van banden op de markt

- Kunststoffen losmaken voor het opladen van Internet-of-Things-apparaten
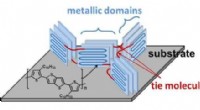
- Nieuwe aanpak kan leiden tot ontworpen kunststoffen met specifieke eigenschappen

- Waarom sommige groenen bruin worden in historische schilderijen

 Welke grote Joviaanse maan wordt verondersteld te zijn gevangen in zijn huidige baan?
Welke grote Joviaanse maan wordt verondersteld te zijn gevangen in zijn huidige baan?  Hoe lang duurt het voordat de zon opblaast?
Hoe lang duurt het voordat de zon opblaast?  Hoe algenbiodiesel werkt
Hoe algenbiodiesel werkt  Zou een mens met speciale vaardigheden kunnen eindigen als ze meer chromosomen hadden dan normaal?
Zou een mens met speciale vaardigheden kunnen eindigen als ze meer chromosomen hadden dan normaal?  Modelleren van vulkanische puinwolken
Modelleren van vulkanische puinwolken Waarom zijn bergen natter?
Waarom zijn bergen natter?  Het voorgestelde verbod van het VK kan belangrijke producten met microplastics missen
Het voorgestelde verbod van het VK kan belangrijke producten met microplastics missen Nadat eBay zijn vertaalsoftware had verbeterd, internationale handel sterk gestegen
Nadat eBay zijn vertaalsoftware had verbeterd, internationale handel sterk gestegen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

