
Wetenschap
Waarom is chloormethaan meer polair dan methaan?
Dit is waarom:
* elektronegativiteit: Chloor is meer elektronegatief dan koolstof. Dit betekent dat chloor een sterkere aantrekkingskracht heeft op elektronen in de C-CL-binding.
* Polaire binding: De ongelijke delen van elektronen in de C-CL-binding creëert een gedeeltelijke negatieve lading (Δ-) op het chlooratoom en een gedeeltelijke positieve lading (δ+) op het koolstofatoom. Dit creëert een dipoolmoment in het molecuul.
* Moleculaire geometrie: Chloormethaan heeft een tetraëdrische vorm, met het chlooratoom asymmetrisch geplaatst. Deze vorm, gecombineerd met het dipoolmoment, resulteert in een netto dipoolmoment voor het hele molecuul.
Methaan heeft daarentegen alleen koolstofhydrogene bindingen. Waterstof en koolstof hebben vergelijkbare elektronegativiteitswaarden, dus de C-H-bindingen zijn in wezen niet-polair. Aangezien er geen significante polaire bindingen zijn, heeft methaan geen algemeen dipoolmoment en is een niet -polair molecuul.
Samenvattend: Chloormethaan heeft een polaire C-Cl-binding en een netto dipoolmoment vanwege de moleculaire geometrie, waardoor het een polair molecuul is. Methaan heeft geen significante polaire bindingen en geen netto dipoolmoment, waardoor het een niet -polair molecuul is.
 Waarom leidt vloeibare KCL elektriciteit?
Waarom leidt vloeibare KCL elektriciteit?  Waarom reageren kaliumnitraat en suiker zo dat er rook ontstaat?
Waarom reageren kaliumnitraat en suiker zo dat er rook ontstaat?  Calciumsulfide vormt zich wanneer calcium 2 valentie -elektronen verliest tot zwavel. Welk type van een binding wordt gevormd?
Calciumsulfide vormt zich wanneer calcium 2 valentie -elektronen verliest tot zwavel. Welk type van een binding wordt gevormd?  Wat waren de eerste vier elementen die in de chemie werden gebruikt?
Wat waren de eerste vier elementen die in de chemie werden gebruikt?  Wanneer twee heldere vloeistoffen worden gemengd en er een gele kleur ontstaat, is er sprake van chemische verandering?
Wanneer twee heldere vloeistoffen worden gemengd en er een gele kleur ontstaat, is er sprake van chemische verandering?
 Welke kenmerken onderscheiden binnenplanten van buitenplaneten?
Welke kenmerken onderscheiden binnenplanten van buitenplaneten?  Behoud of ontwikkeling? Brazilië Amazon op een kruispunt
Behoud of ontwikkeling? Brazilië Amazon op een kruispunt Glacioloog probeert de impact van de opwarming van de aarde op de Aziatische gletsjers te kwantificeren
Glacioloog probeert de impact van de opwarming van de aarde op de Aziatische gletsjers te kwantificeren Voorbeelden van natuurrampen en de milieuveranderingen die zijn ontstaan
Voorbeelden van natuurrampen en de milieuveranderingen die zijn ontstaan  Wat is een manier om wetenschap te begrijpen of wat kunt u doen om uw kennis in de wetenschap te verbeteren?
Wat is een manier om wetenschap te begrijpen of wat kunt u doen om uw kennis in de wetenschap te verbeteren?
Hoofdlijnen
- Parasieten van huisdieren die dieren in het wild wereldwijd aantasten
- Wat zijn Palade -deeltjes en waarom ze dat hebben gebeld?
- Wat zijn de drie belangrijkste soorten rna?
- Hoe beïnvloedt biologie uw kleding?
- Wat doet Mitochondrion?
- Welke mechanismen leiden tot genetische variatie?
- Is bacteriën een voorbeeld van eukaryotische cellen?
- Wat zijn twee manieren waarop schimmels mensen kunnen helpen?
- Wat is de selectie door mensen voor het fokken van nuttige eigenschappen van natuurlijke variatie tussen verschillende organismen?
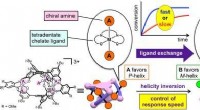
- Chiraliteitsinversie in een spiraalvormig molecuul bij gecontroleerde snelheden
- Computerprogramma kan een 2D-tekening in vrije vorm vertalen naar een DNA-structuur
- Nobelprijs voor scheikunde eert groenere manier om moleculen te bouwen

- Ionisch defectlandschap in perovskiet-zonnecellen onthuld

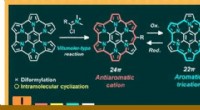
- In stikstof ingebedde polycyclische verbinding met sterke anti-aromaticiteit en stabiliteit
 De kleinste sterren worden sterren genoemd.
De kleinste sterren worden sterren genoemd.  Is het waar dat Altostratus -wolken lager zijn dan gewone Stratus -wolken?
Is het waar dat Altostratus -wolken lager zijn dan gewone Stratus -wolken?  Hoe snel verspreidden de dingen zich
Hoe snel verspreidden de dingen zich  Wat voor soort fysiek kenmerk zijn Trinidad Java en Kyushu?
Wat voor soort fysiek kenmerk zijn Trinidad Java en Kyushu?  Hoe lang duurt het om 375 watt energie te genereren met een zonnepaneel van 1 vierkante meter?
Hoe lang duurt het om 375 watt energie te genereren met een zonnepaneel van 1 vierkante meter?  Luxe 1200 jaar oud herenhuis gevonden in Zuid-Israël
Luxe 1200 jaar oud herenhuis gevonden in Zuid-Israël Wat voor soort organisme is een squishy?
Wat voor soort organisme is een squishy?  Eerste gedetailleerde blik op hoe moleculair reuzenrad protonen levert aan cellulaire fabrieken
Eerste gedetailleerde blik op hoe moleculair reuzenrad protonen levert aan cellulaire fabrieken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

