
Wetenschap
Welke heeft de zwakste interactie CO2 NO2 SO2 of H2S?
* intermoleculaire krachten: De sterkte van intermoleculaire interacties tussen moleculen bepaalt hun algehele interactiesterkte.
* CO2: Koolstofdioxide is een lineair molecuul met alleen Londense dispersiekrachten (zwakste type) vanwege zijn niet -polaire aard.
* No2: Stikstofdioxide is een gebogen molecuul met een permanent dipoolmoment, wat leidt tot sterkere dipool-dipoolinteracties.
* SO2: Zwaveldioxide is ook een gebogen molecuul met een permanent dipoolmoment en kan deelnemen aan dipool-dipoolinteracties. Bovendien is zwavel groter en meer polariseerbaar dan zuurstof, waardoor de dispersiekrachten in Londen worden vergroot.
* H2S: Waterstofsulfide heeft een gebogen vorm en kan zwakke interacties voor waterstofbinding vertonen als gevolg van de aanwezigheid van waterstof bevestigd aan een sterk elektronegatief zwavelatoom.
* Polariseerbaarheid: Grotere en complexere moleculen zijn meer polariseerbaar, wat leidt tot sterkere dispersietroepen in Londen. CO2 is de kleinste en minst polariseerbaar onder de vier.
Samenvattend: CO2, niet -polair en met de zwakste intermoleculaire krachten, ervaart de zwakste interactie tussen de gegeven moleculen.
 Revenge of the seabed burrowers:een andere kijk op bioturbatie en oceaanecosystemen
Revenge of the seabed burrowers:een andere kijk op bioturbatie en oceaanecosystemen Een hulpmiddel voor het beoordelen van de overstromingsbestendigheid van ontwikkelingsprojecten
Een hulpmiddel voor het beoordelen van de overstromingsbestendigheid van ontwikkelingsprojecten Welk type ecosysteem komt voor in tropische klimaten en bevat dominante soorten zouttolerante houtachtige planten?
Welk type ecosysteem komt voor in tropische klimaten en bevat dominante soorten zouttolerante houtachtige planten?  Suomi NPP-satelliet vindt tyfoon Shanshan nabij de kust van Japan
Suomi NPP-satelliet vindt tyfoon Shanshan nabij de kust van Japan Oude culturen hielden ook van hun honden
Oude culturen hielden ook van hun honden
Hoofdlijnen
- Waarom GNEP niet naar de toekomst kan springen
- Wat eten orka's in het noordpoolgebied?
- Beïnvloedt lichaamsritmes en interageert met de biologische klok?
- Welk soort zuur zit er in een aardappel?
- Hoeveel cellen heeft een organisme?
- Hoe neemt een forel zuurstof in?
- Is het waar dat willekeurige paring tot micro-evolutie leidt?
- Zien hoe evolutionaire mechanismen biologische diversiteit opleveren
- Welke stap volgt de mitose waarin het cytoplasma verdeelt?
- Chemici ontwikkelen MRI-achtige techniek om te detecteren wat er aan de hand is met batterijen
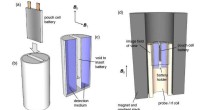
- Bacteriën gebruiken om CO2-afvang in oceanen te versnellen

- Luchtstabiliteit van op natrium gebaseerde gelaagde oxide kathodematerialen
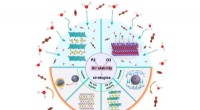
- Eigenschappen van spinnenzijde geanalyseerd voor gebruik als biogebaseerde vezels in de medische sector

- Gebouwen – Beton op de dubbele

 Welke wetenschapper liet zien dat het grootste deel van de massa en positieve lading een atoom in het centrum is geconcentreerd?
Welke wetenschapper liet zien dat het grootste deel van de massa en positieve lading een atoom in het centrum is geconcentreerd?  Een vulkaan barst uit in het zuidwesten van IJsland en spuugt magma uit, een spectaculair vertoon van de kracht van de aarde
Een vulkaan barst uit in het zuidwesten van IJsland en spuugt magma uit, een spectaculair vertoon van de kracht van de aarde  Wat veroorzaakt de dims in de lucht tijdens een zonsverduistering?
Wat veroorzaakt de dims in de lucht tijdens een zonsverduistering?  Hoe lang duurt het voordat de aarde één volledige baan rond de zon voltooit, ook bekend als een platonisch jaar?
Hoe lang duurt het voordat de aarde één volledige baan rond de zon voltooit, ook bekend als een platonisch jaar?  Pompeii:Oude overblijfselen helpen wetenschappers te leren wat er gebeurt met een lichaam dat is gevangen in een vulkaanuitbarsting
Pompeii:Oude overblijfselen helpen wetenschappers te leren wat er gebeurt met een lichaam dat is gevangen in een vulkaanuitbarsting Bio-geïnspireerde camera kan zelfrijdende auto's helpen beter te zien
Bio-geïnspireerde camera kan zelfrijdende auto's helpen beter te zien Wat zijn de subklassen van synoviaal gewricht?
Wat zijn de subklassen van synoviaal gewricht?  Onderzoek geeft inzicht in herstel van baanverlies
Onderzoek geeft inzicht in herstel van baanverlies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

