
Wetenschap
16 L ammoniak werd geproduceerd door het Haber -proces Hoeveel liter waterstof gebruikte tijdens de reactie?
1. Evenwichtige chemische vergelijking:
De Haber -procesreactie is:
N₂ (g) + 3H₂ (g) ⇌ 2NH₃ (g)
Dit vertelt ons dat 3 mol waterstofgas (H₂) reageert om 2 mol ammoniak (NH₃) te produceren.
2. Mol -verhouding:
De molverhouding tussen waterstof en ammoniak is 3:2. Dit betekent dat voor elke 2 mol geproduceerde ammoniak 3 mol waterstof wordt geconsumeerd.
3. Uitgaande van ideaal gasgedrag:
We kunnen de ideale gaswet gebruiken om mol en volume te relateren. Omdat we te maken hebben met gassen bij constante temperatuur en druk, kunnen we aannemen dat het volume recht evenredig is met het aantal mol.
4. Berekening:
* Omdat we 16 L ammoniak hebben, moeten we erachter komen hoeveel liter waterstof nodig is om die hoeveelheid te produceren.
* Met behulp van de molverhouding weten we dat 3 mol waterstof nodig is voor elke 2 mol ammoniak. Dit vertaalt zich in een volumeverhouding van 3:2.
* Om het volume waterstof te vinden, kunnen we een deel instellen:
(3 L H₂) / (2 L NH₃) =(X L H₂) / (16 L NH₃)
* Oplossen voor X (het volume waterstof):
X =(3 L H₂ * 16 L NH₃) / (2 L NH₃) =24 L H₂
Antwoord: 24 liter waterstofgas werd gebruikt om 16 liter ammoniak te produceren.
 Wat is de zuivere stof die niet met gewone chemische middelen in eenvoudiger stoffen kan worden afgebroken?
Wat is de zuivere stof die niet met gewone chemische middelen in eenvoudiger stoffen kan worden afgebroken?  Verrassende antibacteriële activiteit en selectiviteit van hydrofiele fosfoniumpolymeren
Verrassende antibacteriële activiteit en selectiviteit van hydrofiele fosfoniumpolymeren Welk element zou hoogstwaarschijnlijk binden met lithium en een ionische verbinding vormen?
Welk element zou hoogstwaarschijnlijk binden met lithium en een ionische verbinding vormen?  Wat is de reactie van hydrofluorinezuur en kaliumhydroxide?
Wat is de reactie van hydrofluorinezuur en kaliumhydroxide?  Wat is vloeibaar natrium?
Wat is vloeibaar natrium?
Hoofdlijnen
- Hoe reguleert Ph de ademhaling?
- Wat voor soort cel wordt gevormd als chromosomen van een sperma -oproep en een eiermoeken?
- Dugongs zullen waarschijnlijk functioneel uitgestorven zijn in China
- Wat doet Fimbriae?
- Welk systeem is meer geavanceerd bij cnidarians dan Porifera?
- Elements of Nucleic Acids
- Hoe wordt een voorraad genetische monsters van verschillende soorten genoemd?
- Wat zijn twee soorten wetenschapsonderzoeken?
- Welk epitheelweefseltype lijnen het grootste deel van het spijsverteringskanaal?
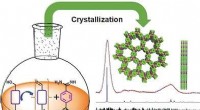
- Superieure fotokatalysatoren - covalent, kristallijne triazine-frameworks
- Wetenschappers gebruiken licht om vetzuren om te zetten in alkanen
- Onderzoekers maken kunstmatig parelmoer met behulp van bacteriën

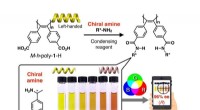
- Kleurcodering moleculaire spiegelbeelden
- Opschalen naar nieuwe hoogten met gekko-geïnspireerde lijm

 Hoe Word Cops anonieme auteurs ontmaskeren
Hoe Word Cops anonieme auteurs ontmaskeren  Wat is de afstand tussen identieke plek op twee golven?
Wat is de afstand tussen identieke plek op twee golven?  Als niets genoeg is:constante ontevredenheid zorgt ervoor dat de perfectionistische student opbrandt
Als niets genoeg is:constante ontevredenheid zorgt ervoor dat de perfectionistische student opbrandt  Welke elementen gevonden in de vrije elementaire staat?
Welke elementen gevonden in de vrije elementaire staat?  In situ extractie en detectie van DNA met behulp van nanoporiën
In situ extractie en detectie van DNA met behulp van nanoporiën Hoe kaliumchloride bereiden
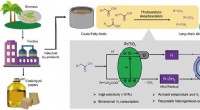
Hoe kaliumchloride bereiden  Met vloeistof doordrenkt glad oppervlak presteert beter dan superhydrofoob oppervlak wat betreft langdurige corrosiebestendigheid
Met vloeistof doordrenkt glad oppervlak presteert beter dan superhydrofoob oppervlak wat betreft langdurige corrosiebestendigheid Welke items worden gebruikt om warmte te verdelen door een bunsenbrander bij het verwarmen van de bodem van smeltkroes?
Welke items worden gebruikt om warmte te verdelen door een bunsenbrander bij het verwarmen van de bodem van smeltkroes?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

