
Wetenschap
Hoeveel liter waterstofgas is nodig om te reageren met CS2 produceren 2,5L CH4 bij STP?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie tussen koolstofdisulfide (CS₂) en waterstofgas (H₂) produceert methaan (CH₄) en waterstofsulfide (H₂s):
CS₂ + 4H₂ → CH₄ + 2H₂S
2. Bepaal de molverhouding tussen H₂ en Ch₄:
Uit de evenwichtige vergelijking zien we dat 4 mol H₂ reageert om 1 mol ch₄ te produceren.
3. Pas de wet van Avogadro toe:
Bij STP (standaardtemperatuur en druk) bevatten gelijke volumes gassen gelijk aantal mol. Daarom is de molverhouding ook de volumeverhouding. Dit betekent dat 4 liter H₂ nodig is om 1 liter CH₄ te produceren.
4. Bereken het benodigde volume van H₂:
We moeten 2,5 liter ch₄ produceren. De volumeverhouding gebruiken vanuit stap 3:
(4 L H₂) / (1 l ch₄) =(x l h₂) / (2,5 l ch₄)
Oplossen voor X:
x =(4 l h₂) * (2,5 l ch₄) / (1 l ch₄) = 10 l H₂
Daarom heeft u 10 liter waterstofgas nodig om met CS₂ te reageren om 2,5 liter ch₄ te produceren bij STP.
 Welke informatie in een evenwichtige chemische vergelijking laat zien hoeveel mol reactant de reactie betreft?
Welke informatie in een evenwichtige chemische vergelijking laat zien hoeveel mol reactant de reactie betreft?  Studie onthult de rol van platina bij de conversie van schone brandstof
Studie onthult de rol van platina bij de conversie van schone brandstof Hoeveel atomen zijn er aanwezig in 18 g C6H12O6?
Hoeveel atomen zijn er aanwezig in 18 g C6H12O6?  Gouddichtheid is ongeveer gelijk aan de dichtheid een platina b tungstun c nicrome d Kantal?
Gouddichtheid is ongeveer gelijk aan de dichtheid een platina b tungstun c nicrome d Kantal?  Kan een materiaal zowel vloeibaar als gas tegelijkertijd zijn?
Kan een materiaal zowel vloeibaar als gas tegelijkertijd zijn?
 Kunnen meerdere carnivoren naast elkaar bestaan in steden?
Kunnen meerdere carnivoren naast elkaar bestaan in steden?  Trump maakt Obama-regels voor auto-emissies ongedaan:officieel
Trump maakt Obama-regels voor auto-emissies ongedaan:officieel Wat toont natuurlijke kenmerken van de aarde?
Wat toont natuurlijke kenmerken van de aarde?  Hitte is een serieuze bedreiging voor melkkoeien - vonden innovatieve manieren om ze koel te houden
Hitte is een serieuze bedreiging voor melkkoeien - vonden innovatieve manieren om ze koel te houden Hoe bos is belangrijk voor vogels?
Hoe bos is belangrijk voor vogels?
Hoofdlijnen
- De virale reproductieve cyclus waarin een faag zijn DNA in gastheercel injecteert en de metabole machines gebruikt om nieuwe fagen te produceren, veroorzaakt dan dat breuk wordt genoemd welke cyclus?
- Isopora of niet? Een verkeerde identiteit leidt onderzoekers naar twee nieuwe uitgestorven koraalsoorten
- Nieuw inzicht in hoe planten cellulose maken
- Nieuwe dinosaurus liet nakomelingen zien hoe ze indruk moesten maken
- Wat zijn de drie hoofdfuncties van bloed?
- Namen van de enzymen in de mond & slokdarm
- Wat is het doel van metabole paden?
- Wat is het kleine verschil tussen objecten of organismen die hetzelfde basistype zijn?
- Eten en drinken, wat het over ons zegt
- Nieuwe methode voor functionalisering van koolstof-waterstofbindingen in een laat stadium
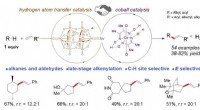
- Video:Hoe werkt airconditioning?

- Supercomputermodellen beschrijven de rol van chloriden bij corrosie
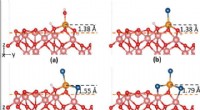
- Op ijzer gebaseerde katalysatoren ontdekt in door licht aangedreven kooldioxidehydrogenering

- Een nieuwe gids voor ontdekkingsreizigers van de submicroscopische wereld in ons

 Wanneer wordt gezegd dat een balk een uniforme lengte heeft?
Wanneer wordt gezegd dat een balk een uniforme lengte heeft?  Wat worden enkele technieken gebruikt om planeten te ontdekken?
Wat worden enkele technieken gebruikt om planeten te ontdekken?  Is CaSO4 ionisch of covalent gebonden?
Is CaSO4 ionisch of covalent gebonden?  Wat is de beste telescoop voor het bekijken van planeten in de nachtelijke hemel?
Wat is de beste telescoop voor het bekijken van planeten in de nachtelijke hemel?  Wat is de verandering van vloeistof naar gas?
Wat is de verandering van vloeistof naar gas?  Technologische vooruitgang heeft al gevolgen voor geschoolde bedienden en ongeschoolde arbeiders
Technologische vooruitgang heeft al gevolgen voor geschoolde bedienden en ongeschoolde arbeiders Waarom hebben Cinder Kegels van korte duur?
Waarom hebben Cinder Kegels van korte duur?  Hoe een mutatie in het SKD3-enzym de MGCA7-ziekte kan veroorzaken
Hoe een mutatie in het SKD3-enzym de MGCA7-ziekte kan veroorzaken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

