
Wetenschap
Waarom is natriumchloride oplosbaar in water maar geen alcohol?
Oplosbaarheid:een kwestie van aantrekkingskracht
Oplosbaarheid gaat over het vermogen van de ene stof (de opgeloste stof) om in een andere (het oplosmiddel) op te lossen. De belangrijkste factor die oplosbaarheid bepaalt, is de relatieve sterkte van de attracties tussen:
* Solute-solute attracties: De krachten die de opgeloste moleculen (of ionen, in het geval van NaCl) houden.
* attracties van oplosmiddel-oplosmiddel: De krachten houden de oplosmiddelmoleculen bij elkaar.
* Attracties opgeloste oplosmiddel: De krachten die zich ontwikkelen tussen de opgeloste en oplosmiddelmoleculen.
Water:een polair oplosmiddel
* Water (h₂o) is een polaire molecuul. Dit betekent dat het een enigszins positief uiteinde heeft (de waterstofatomen) en een enigszins negatief uiteinde (het zuurstofatoom). Met deze polariteit kunnen watermoleculen sterke waterstofbindingen vormen met elkaar.
* Wanneer NaCl oplost in water, de positieve natriumionen (Na⁺) worden aangetrokken tot het negatieve uiteinde van de watermoleculen, terwijl de negatieve chloride -ionen (CL⁻) worden aangetrokken door het positieve uiteinde van de watermoleculen.
* Deze sterke ion-dipool interacties overwinnen de ionische bindingen die de natrium- en chloride -ionen in het kristalrooster vasthouden, waardoor het zout kan oplossen.
alcohol:een minder polair oplosmiddel
* De meeste alcoholen, zoals ethanol (c₂h₅oh), zijn minder polair dan water. Ze hebben een zwakkere dipoolmoment en vormen zwakkere waterstofbruggen met elkaar.
* alcoholen Voornamelijk vertrouwen op zwakkere dispersiekrachten in Londen om elkaar aan te trekken.
* Terwijl alcoholen enkele waterstofbindingen kunnen vormen Met ionen zijn deze interacties niet sterk genoeg om de sterke ionische attracties in het NaCl -kristalrooster te overwinnen.
De bottom line
Kortom, de sterke polariteit en het vermogen van water om sterke ion-dipool interacties met de ionen in NaCl te vormen, maakt het in staat om het zout op te lossen. Alcoholen, minder polair, kunnen niet sterk genoeg interacties vormen om de ionische bindingen binnen de NaCl -structuur te verstoren, waardoor het oplossen van oplossing wordt voorkomen.
 Zonnepanelen, veganistische diëten, geen vluchten:ontmoet Amerikaanse klimaatrevolutionairen
Zonnepanelen, veganistische diëten, geen vluchten:ontmoet Amerikaanse klimaatrevolutionairen Wat is een kortere definitie van het broeikaseffect?
Wat is een kortere definitie van het broeikaseffect?  Nieuwe beeldvormingsmethode bekijkt bodemkoolstof op bijna atomaire schaal
Nieuwe beeldvormingsmethode bekijkt bodemkoolstof op bijna atomaire schaal Wat is dit als het krijgen van hogere bomen wordt korter en de atmosfeer dunner?
Wat is dit als het krijgen van hogere bomen wordt korter en de atmosfeer dunner?  Medisch afval stapelt zich op in het virusepicentrum van Italië
Medisch afval stapelt zich op in het virusepicentrum van Italië
Hoofdlijnen
- Handelen of niet handelen? De ivoren impasse doorbreken
- Cultureel liften:hoe sociaal gedrag de genetische samenstelling van dolfijnen kan beïnvloeden
- Wat zijn coliforme bacteriën?
- Welke cellen bevatten chloroplasten?
- Wat is een adaptief voordeel voor het beperken van DNA in een kern?
- Hadden dinosaurussen lippen?
- Waarom zijn mensen meer als dieren dan op planten?
- Hoeveel chromosoom zijn er in de menselijke darmcel bij anafase?
- Hoe omgaan dieren met de dieren?
- Hybride materiaal kan in verschillende toepassingen beter presteren dan grafeen

- Onderzoekers passen een snelle en effectieve strategie voor verrijking van N-fosfopeptiden aan
- Een virtueel substraat opent de weg naar oxidefilms op silicium voor toepassing in 5G, MEMS, sensoren en kwantumberekening

- Enkelkristallijne quaternaire sulfide nanobelts

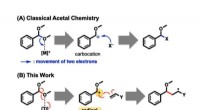
- Radicale chemie maakt eenvoudige synthese van ethers mogelijk
 Om de bosbrandcrisis in Australië te begrijpen, moet je moeilijke vragen stellen - en naar de antwoorden luisteren
Om de bosbrandcrisis in Australië te begrijpen, moet je moeilijke vragen stellen - en naar de antwoorden luisteren Welk proces zet de Suns Energy om in suikers?
Welk proces zet de Suns Energy om in suikers?  Is een chimpansee herbivore carnivore of een alleswinkel?
Is een chimpansee herbivore carnivore of een alleswinkel?  Lijst 5 eigenschappen die de meeste organismen hebben?
Lijst 5 eigenschappen die de meeste organismen hebben?  Zwaartekrachtkrachten in protoplanetaire schijven kunnen superaarde dicht bij hun sterren duwen
Zwaartekrachtkrachten in protoplanetaire schijven kunnen superaarde dicht bij hun sterren duwen Lessen uit het verleden:vrouwen en meisjes beschermen tegen geweld tijdens COVID-19
Lessen uit het verleden:vrouwen en meisjes beschermen tegen geweld tijdens COVID-19 Wat is het fossiel op openingsscène van Journey to Center Earth?
Wat is het fossiel op openingsscène van Journey to Center Earth?  Wat is het resultaat van hydrolyse van een dipeptide?
Wat is het resultaat van hydrolyse van een dipeptide?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

