
Wetenschap
Bij het vergelijken van het vriespunt en het koken van verschillende stoffen de?
1. Intermoleculaire krachten:
* sterkere intermoleculaire krachten (IMFS) leiden tot hogere vriespunten en kookpunten .
* waterstofbinding: Het sterkste IMF, gevonden in moleculen met H gebonden aan O, N of F.
* Dipole-dipole interacties: Komen tussen poolmoleculen op.
* Dispersietroepen in Londen: Zwakste IMF, aanwezig in alle moleculen.
* Zwakkere IMF's leiden tot lagere vriespunten en kookpunten .
2. Moleculaire grootte en gewicht:
* grotere moleculen met hogere molecuulgewichten Over het algemeen hebben hogere kookpunten vanwege verhoogde disperstroepen in Londen.
3. Vertakking:
* vertakte moleculen Over het algemeen hebben lagere kookpunten dan hun lineaire tegenhangers. Dit komt omdat vertakking het beschikbare oppervlak vermindert voor intermoleculaire interacties.
4. Druk:
* Hogere druk leidt tot hogere kookpunten en Lagere vriespunten.
5. Onzuiverheden:
* onzuiverheden Over het algemeen Verlaag het vriespunt en Verhoog het kookpunt .
Voorbeeld:
* Water (H₂o) heeft een hoog kookpunt (100 ° C) en vriespunt (0 ° C) als gevolg van sterke waterstofbinding.
* Ethanol (ch₃ch₂oh) heeft ook waterstofbinding, maar het is zwakker dan in water, wat leidt tot een lager kookpunt (78 ° C) en vriespunt (-114 ° C).
* Methaan (CH₄) is een niet-polair molecuul met alleen Londense dispersiekrachten, wat leidt tot een zeer laag kookpunt (-161 ° C) en vriespunt (-182 ° C).
Concluderend, bij het vergelijken van het vriespunt en het kookpunt van verschillende stoffen, moeten we rekening houden met de sterkte van intermoleculaire krachten, moleculaire grootte en gewicht, vertakking, druk en onzuiverheden.
 Klimaatverandering, bevolkingsgroei en gestresste planten:de wereld voeden in de 21e eeuw
Klimaatverandering, bevolkingsgroei en gestresste planten:de wereld voeden in de 21e eeuw Hoe schildpadden groeien en leven
Hoe schildpadden groeien en leven  Wetenschappers komen samen om ozon te bestuderen, een atmosferisch mysterie in de buurt van Lake Michigan
Wetenschappers komen samen om ozon te bestuderen, een atmosferisch mysterie in de buurt van Lake Michigan Kansas goed eigenaren, eigenaren van niet-bronnen hebben verschillende bewateringsroutines tijdens droogte
Kansas goed eigenaren, eigenaren van niet-bronnen hebben verschillende bewateringsroutines tijdens droogte Plattelandsbewoners in Alaska hebben moeite om toegang te krijgen tot water en dit te betalen
Plattelandsbewoners in Alaska hebben moeite om toegang te krijgen tot water en dit te betalen
Hoofdlijnen
- Tegelijkertijd inzoomen door tijd en ruimte met superresolutie om te begrijpen hoe cellen zich delen
- Geheimen van de naakte molrat:nieuw onderzoek onthult hoe hun unieke metabolisme hen beschermt tegen hartaanvallen
- Wat is de wetenschappelijke naam van Eggwhite?
- Plasmacellen ontwikkelen zich uit getransformeerde B- of T -cellen?
- Wat zijn het aantal cellen bij beginnende divisie -mitose?
- Wat was er eerst:de kip of het ei?
- Het ribosoom interpreteert het mRNA om een reeks van te produceren?
- Basisvereisten voor groei in prokaryoten en eukaryoten
- Wat is de functie van een schort in de wetenschap?
- Wetenschappers vinden moleculaire vernietigingscode voor enzym dat betrokken is bij cholesterolproductie

- Machine learning voorspelt mechanische eigenschappen van poreuze materialen
- Onderzoekers ontdekken SARS-CoV-2-remmers
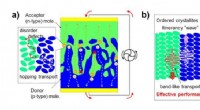
- Ladingsdragers volgen in het moleculaire kristal op organische pn-junctie
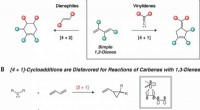
- Een manier om een twee-nikkelkatalysator te gebruiken om cyclopentenen te synthetiseren
 Sportpartnerschappen met non-profitorganisaties laten matige resultaten zien, zo blijkt uit onderzoek
Sportpartnerschappen met non-profitorganisaties laten matige resultaten zien, zo blijkt uit onderzoek  Gelijkaardige richels op Mars hebben verschillende oorsprongen
Gelijkaardige richels op Mars hebben verschillende oorsprongen Wat gebeurt er als Gram Positive Cell niet wordt ontkleurd?
Wat gebeurt er als Gram Positive Cell niet wordt ontkleurd?  Juradieet:waarom onze kennis van wat oude pterosauriërs aten verkeerd zou kunnen zijn
Juradieet:waarom onze kennis van wat oude pterosauriërs aten verkeerd zou kunnen zijn  Banken doen te weinig om hun duurzame beleggingsproducten te communiceren
Banken doen te weinig om hun duurzame beleggingsproducten te communiceren Hoeveel mol zuurstof worden geproduceerd uit 14 kaliumchloraat?
Hoeveel mol zuurstof worden geproduceerd uit 14 kaliumchloraat?  Indringende vraag:Is het Electoral College een verouderd systeem?
Indringende vraag:Is het Electoral College een verouderd systeem?  Onderzoek wijst uit hoe turbulentie kan worden gebruikt om patronen te genereren
Onderzoek wijst uit hoe turbulentie kan worden gebruikt om patronen te genereren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

