
Wetenschap
Wat is de reactiviteit van cesium?
* Lage ionisatie -energie: Cesium heeft de laagste ionisatie -energie van alle elementen, wat betekent dat het gemakkelijk zijn buitenste elektron verliest om een positief geladen ion te worden (CS+). Dit maakt het zeer gevoelig om te reageren met andere stoffen.
* Grote atoomradius: Cesium heeft een grote atoomradius, wat betekent dat het buitenste elektron verder van de kern ligt en minder strak wordt gehouden. Dit maakt het gemakkelijker om het elektron te verwijderen, wat bijdraagt aan zijn hoge reactiviteit.
* elektropositiviteit: Cesium is zeer elektropositief, wat betekent dat het een sterke neiging heeft om elektronen te verliezen en positieve ionen te vormen.
reacties en eigenschappen:
* reageert met water: Cesium reageert explosief met water en brengt een grote hoeveelheid warmte en waterstofgas vrij. Deze reactie is nog krachtiger dan de reactie van andere alkali -metalen zoals natrium en kalium.
* reageert met zuurstof: Cesium reageert met zuurstof in lucht om cesiumoxide (CS₂O) te vormen en explodeert zelfs in zuivere zuurstof.
* reageert met halogenen: Cesium reageert gemakkelijk met halogenen (fluor, chloor, broom, jodium) om cesiumhalogeniden te vormen.
* reageert met zuren: Cesium reageert heftig met zuren en brengt waterstofgas vrij.
Veiligheid:
* Extreme reactiviteit: Cesium is zo reactief dat het met extreme voorzichtigheid moet worden afgehandeld. Het wordt meestal opgeslagen onder inerte atmosferen om contact met lucht en vocht te voorkomen.
* Explosieve reacties: De reacties van cesium met water, zuurstof en andere stoffen zijn zeer exotherme en kunnen explosief zijn.
Toepassingen:
Ondanks zijn hoge reactiviteit heeft Cesium enkele toepassingen in:
* atomaire klokken: Caesium-133 wordt gebruikt in atomaire klokken, die ongelooflijk precieze tijdwaarderingsapparaten zijn.
* Olie -exploratie: Cesiumverbindingen worden gebruikt in olie -exploratie om olie- en gasafzettingen te identificeren.
Samenvattend is de hoge reactiviteit van Cesium te wijten aan de lage ionisatie -energie, grote atoomradius en elektropositiviteit. Het is het meest reactieve element op het periodiek systeem en vereist zorgvuldige behandeling vanwege de explosieve reacties met verschillende stoffen.
 Heroverwegen van oerbossen door korstmossen te gebruiken als indicator van de instandhoudingswaarde
Heroverwegen van oerbossen door korstmossen te gebruiken als indicator van de instandhoudingswaarde Welke invloed heeft de bodem op de natuurlijke vegetatie die op bepaalde plaatsen kan groeien?
Welke invloed heeft de bodem op de natuurlijke vegetatie die op bepaalde plaatsen kan groeien?  Italiaanse gletsjer bedekt om langzaam te smelten
Italiaanse gletsjer bedekt om langzaam te smelten Betreft pseudowetenschap de natuurlijke wereld?
Betreft pseudowetenschap de natuurlijke wereld?  boerderijen, tabellen en enorme effecten tussen en daarbuiten
boerderijen, tabellen en enorme effecten tussen en daarbuiten
Hoofdlijnen
- Komt de gemanipuleerde 'Frankenfish' naar de tafel van het land?
- Zou een wetenschapper in deze populatie van organismen hoogstwaarschijnlijk direct bewijs van evolutionaire verandering kunnen waarnemen?
- Wat is een epidermale cel?
- Welke cellulaire ademhaling maakt de meeste NADH?
- Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
- Een groep gespecialiseerde cellen vormt eerst een wat?
- "Fingerprint Experiments
- Leg uit waarom planten stoppen met het produceren van glucose wanneer de zon ondergaat?
- Hoe planten vrienden worden met schimmels
- Een natuurlijk voorkomende bodembacterie kan een oplossing bieden voor eeuwigdurende chemicaliën
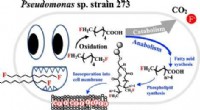
- Natuurkundigen maken een model om de eigenschappen van elk molecuul te voorspellen

- Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting

- Leerachtige materialen maken van schimmels

- Nieuw materiaal met magnetisch vormgeheugen

 Hoe defecten de efficiëntie bij de betonproductie beïnvloeden
Hoe defecten de efficiëntie bij de betonproductie beïnvloeden  Autonoom systeem verbetert milieubemonstering op zee
Autonoom systeem verbetert milieubemonstering op zee Door licht aangedreven nano-organismen verbruiken CO2, milieuvriendelijke kunststoffen en brandstoffen maken
Door licht aangedreven nano-organismen verbruiken CO2, milieuvriendelijke kunststoffen en brandstoffen maken Cyberbeveiliging van het elektriciteitsnet zal duur zijn - wie betaalt, en hoe veel?
Cyberbeveiliging van het elektriciteitsnet zal duur zijn - wie betaalt, en hoe veel? Zijn er dieren zonder cellen?
Zijn er dieren zonder cellen?  Gedragswetenschappelijke modellen kunnen helpen bij het identificeren van de groenste veranderingen in het voedingspatroon
Gedragswetenschappelijke modellen kunnen helpen bij het identificeren van de groenste veranderingen in het voedingspatroon Studie onthult hoe grote droogtes in de Grotere Mekong leiden tot uitbarstingen van kooldioxide-emissies
Studie onthult hoe grote droogtes in de Grotere Mekong leiden tot uitbarstingen van kooldioxide-emissies Hoe de muis de reus overleefde
Hoe de muis de reus overleefde
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

