
Wetenschap
Onderzoekers ontcijferen hoe een enzym het genetisch materiaal in de celkern wijzigt
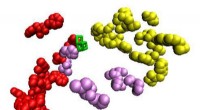
PRMT5 behoort tot een familie van enzymen die eiwit-arginine-methyltransferasen worden genoemd en die verantwoordelijk zijn voor het toevoegen van methylgroepen aan specifieke arginine-aminozuren in eiwitten. In het geval van PRMT5 richt het zich specifiek op histoneiwitten en methyleert het, die essentiële componenten zijn van chromatine, de complexe structuur die DNA in de celkern verpakt.
Door middel van gedetailleerde biochemische en structurele studies onthulden de onderzoekers de precieze moleculaire interacties die plaatsvinden tussen PRMT5 en histonen. Ze identificeerden belangrijke aminozuren en bindingsplaatsen binnen het enzym die cruciaal zijn voor het vermogen om specifieke histonstaarten te herkennen en te methyleren.
De onderzoekers ontdekten ook de opeenvolgende volgorde waarin PRMT5 histonen modificeert, door stapsgewijs methylgroepen aan verschillende plaatsen toe te voegen. Dit opeenvolgende methyleringsproces leidt tot specifieke patronen van histonmodificaties, die op hun beurt de genexpressie beïnvloeden.
Het begrijpen van de moleculaire mechanismen achter de activiteit van PRMT5 heeft aanzienlijke implicaties voor verschillende gebieden van de biologie en geneeskunde. Ontregeling van PRMT5-activiteit is in verband gebracht met verschillende ziekten, waaronder bepaalde soorten kanker en neurologische aandoeningen. Door een dieper inzicht te krijgen in de functies van PRMT5 kunnen onderzoekers potentiële therapeutische strategieën onderzoeken die de activiteit ervan moduleren en normale cellulaire processen herstellen.
Deze doorbraak in het begrijpen van enzymgemedieerde histonmodificaties maakt de weg vrij voor toekomstige studies over de chromatinedynamiek en genregulatie. Het opent nieuwe wegen voor het ontcijferen van de complexe wisselwerking tussen epigenetische modificaties en cellulaire processen, en biedt waardevolle inzichten in fundamentele biologische mechanismen en ziekteontwikkeling.
 Video:Hoe drakenbloed je leven kan redden
Video:Hoe drakenbloed je leven kan redden Nikkel in de schijnwerpers voor röntgenstraling
Nikkel in de schijnwerpers voor röntgenstraling Ingenieurs ontwikkelen technologie om specifieke verontreinigingen uit drink- en afvalwater te halen, pijpleidingen
Ingenieurs ontwikkelen technologie om specifieke verontreinigingen uit drink- en afvalwater te halen, pijpleidingen Vooruitgang in de goedkope elektrochemische synthese van ammoniak
Vooruitgang in de goedkope elektrochemische synthese van ammoniak Team ontwikkelt machine met als doel een einde te maken aan textielverspilling
Team ontwikkelt machine met als doel een einde te maken aan textielverspilling
Hoofdlijnen
- Hoe evolueren bacteriën in de darm in de loop van een jaar?
- Hoe grassen inteelt vermijden
- Hoe biomimicry werkt
- Cilia: definitie, types en functie
- De mysterieuze Denisovans
- Waarom krult je haar in de zomer? Een scheikundige legt de wetenschap achter structuur uit
- Nieuwe inzichten helpen verklaren waarom seksuele interacties tussen mensen van hetzelfde geslacht zo belangrijk zijn voor vrouwelijke bonobo's
- Wat zijn de vier stikstofhoudende bases van DNA?
- Welke moleculen komen in de Krebs-cyclus en welke moleculen verlaten de Krebs-cyclus?
- Waarom laten mensen twee sets tanden groeien? Deze buideldieren herschrijven het verhaal van tandheelkundige evolutie
- Een ecologische afweging? Zonne-energie op nutsschaal belemmert bedreigde panters uit Florida

- Nieuwe ontwikkelingen in van stamcellen afgeleid muisembryomodel
- Door schadesporen in kaart te brengen, kunnen onderzoekers het water volgen in Photosystem II
- Twee Caribische vogelvangbomen vernoemd naar twee vrouwen met over het hoofd gezien botanische werken

 Indringende vraag:Wat is de beste manier om met vervelende collega's om te gaan?
Indringende vraag:Wat is de beste manier om met vervelende collega's om te gaan?  Indonesiës boze Kind van Krakatoa dendert door
Indonesiës boze Kind van Krakatoa dendert door Hoe bereken ik cumulatieve percentages?
Hoe bereken ik cumulatieve percentages?  Enquête onthult de impact van COVID-19 op kleine bedrijven, non-profitorganisaties
Enquête onthult de impact van COVID-19 op kleine bedrijven, non-profitorganisaties Neuron en synaps-mimetische spintronica-apparaten ontwikkeld
Neuron en synaps-mimetische spintronica-apparaten ontwikkeld Instagram voegt geverifieerde accounts toe om slechte acteurs te stoppen
Instagram voegt geverifieerde accounts toe om slechte acteurs te stoppen Australië signalen verschuiving weg van bedrog met klimaatkrediet
Australië signalen verschuiving weg van bedrog met klimaatkrediet Het verschil tussen genomisch DNA en plasmide-DNA
Het verschil tussen genomisch DNA en plasmide-DNA
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

