
Wetenschap
Wanneer 127 g koper reageert met 32 g zuurstofgas om II -oxide NO te vormen of overblijft hoeveel geproduceerd?
1. Schrijf de gebalanceerde chemische vergelijking
De reactie tussen koper (Cu) en zuurstof (O₂) om koper (II) oxide (CuO) te vormen, is:
2 cu + o₂ → 2 cuo
2. Bereken mol reactanten
* mol koper:
- Molaire massa van koper (Cu) =63,55 g/mol
- mol Cu =127 g / 63,55 g / mol =2 mol
* mol zuurstof:
- Molaire zuurstofmassa (o₂) =32 g/mol
- mol o₂ =32 g / 32 g / mol =1 mol
3. Bepaal de beperkende reactant
De evenwichtige vergelijking vertelt ons dat 2 mol Cu reageert met 1 mol o₂. Omdat we 2 mol Cu en 1 mol O₂ hebben, is zuurstof de beperkende reactant. Dit betekent dat de hoeveelheid geproduceerde koper (II) oxide wordt bepaald door hoeveel zuurstof beschikbaar is.
4. Bereken mol koper (II) geproduceerde oxide
Uit de evenwichtige vergelijking zien we dat 1 mol O₂ 2 mol Cuo produceert.
* Mol cuo =1 mol o₂ * (2 mol cuo / 1 mol o₂) =2 mol cuo
5. Bereken de massa van koper (II) geproduceerde oxide
* Molaire massa van CuO =63,55 g/mol (cu) + 16,00 g/mol (O) =79,55 g/mol
* Massa van Cuo =2 mol Cuo * 79,55 g/mol =159,1 g
Antwoord:
159.1 g koper (II) oxide (CUO) zal worden geproduceerd.
 Australië keurt grote nieuwe fossiele brandstofprojecten goed
Australië keurt grote nieuwe fossiele brandstofprojecten goed Direct bewijs van gescheiden oceanische korst gevangen in de overgangszone van de mantel
Direct bewijs van gescheiden oceanische korst gevangen in de overgangszone van de mantel Waarom hebben groene planten de zon nodig?
Waarom hebben groene planten de zon nodig?  Soorten bodem en hun gebruik
Soorten bodem en hun gebruik  VN waarschuwt voor paradigmaverschuiving die nodig is om wereldwijde klimaatchaos te voorkomen
VN waarschuwt voor paradigmaverschuiving die nodig is om wereldwijde klimaatchaos te voorkomen
Hoofdlijnen
- Staan we aan het begin van het einde van de westerse beschaving?
- Waarom moeten cellen een optimaal intern milieu behouden?
- Een homozygote blauwe bloem BB is gekruist met een witte BB Wat zijn de mogelijke genotypen en fenotypes van nakomelingen?
- Virusgenomen helpen verklaren waarom een belangrijke veeziekte opnieuw de kop opsteekt in Europa
- Drang om samen te voegen:begrijpen hoe cellen samensmelten
- Welk schip bevat sluitspier?
- Het bestuderen van de ongelijkheid in rijkdom bij dieren kan aanwijzingen onthullen over hoe hun samenlevingen zich ontwikkelden
- Luie mieren maken zichzelf op onverwachte manieren nuttig
- Welke term identificeert het proces dat door cel wordt gebruikt om grote moleculen binnen te brengen?
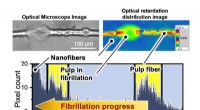
- Het bepalen van de verslanking van houtpulp
- Het spelalgoritme dat het materiaalontwerp zou kunnen verbeteren
- Kunststoffen en de vloek van duurzaamheid

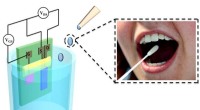
- Biologische sensor kan glucosespiegels in speeksel nauwkeuriger en kostenefficiënter detecteren dan bloedonderzoek
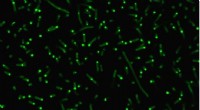
- Onderzoekers creëren kunstmatige organellen om cellulair gedrag te controleren
 Nieuwe processen ontwikkelen om enkele van de zeldzaamste en meest giftige elementen op aarde te onderzoeken
Nieuwe processen ontwikkelen om enkele van de zeldzaamste en meest giftige elementen op aarde te onderzoeken Wat gebeurt er met watermoleculen als ze verdampen?
Wat gebeurt er met watermoleculen als ze verdampen?  Nobel werpt licht op paleogenetica, studie van oud DNA
Nobel werpt licht op paleogenetica, studie van oud DNA Hoe levende systemen oplossingen voor problemen bedenken
Hoe levende systemen oplossingen voor problemen bedenken  Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti
Minstens 304 doden, 1, 800 gewonden bij krachtige aardbeving in Haïti Met medicijnen beladen synthetische nanodeeltjes kunnen longkankercellen onderscheiden van gezonde cellen
Met medicijnen beladen synthetische nanodeeltjes kunnen longkankercellen onderscheiden van gezonde cellen Hoe vormen wij mensen de aarde naast natuurlijke krachten?
Hoe vormen wij mensen de aarde naast natuurlijke krachten?  Coronavirus heeft de kracht van sociale netwerken in een crisis onthuld
Coronavirus heeft de kracht van sociale netwerken in een crisis onthuld
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

