
Wetenschap
Wat gebeurt er als fluor wordt gereageerd met kaliumchloride?
* fluor is reactiever dan chloor. Dit betekent dat het een sterkere aantrekkingskracht heeft op elektronen.
* Fluor verplaatst chloor van het kaliumchloride.
De chemische vergelijking voor de reactie is:
F₂ (g) + 2kcl (s) → 2kf (s) + cl₂ (g)
Hier is een uitsplitsing:
* reactanten:
* fluor (f₂) is een diatomee gas.
* kaliumchloride (KCL) is een vaste ionische verbinding.
* Producten:
* kaliumfluoride (kf) is een vaste ionische verbinding.
* chloor (Cl₂) is een diatomee gas.
In wezen resulteert de reactie in de vorming van kaliumfluoride en chloorgas.
Belangrijke opmerking: Deze reactie is zeer exotherme, wat betekent dat het een aanzienlijke hoeveelheid warmte vrijgeeft. Het moet met extreme voorzichtigheid worden uitgevoerd vanwege het potentieel voor brand of explosie.
Hoofdlijnen
- Welke cellen verliezen hun vermogen om te repliceren en te verdelen?
- Antropologen beschrijven derde orang-oetansoort
- Duurzaamheid van visserij gekoppeld aan genderrollen onder handelaren
- Wat zijn de gevolgen van menselijke activiteit op Mauri -stroom en dieren?
- Welk kenmerk vindt plaats in alle systemen het lichaam?
- Wetenschap is een torpedojager of maker?
- Wat is de beste manier om te bepalen of een cel van plant of dier komt?
- Doorbraak in het begrijpen hoe dodelijke pneumokokken de immuunafweer vermijden
- Welk enzym is betrokken bij RNA -verlenging?
- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
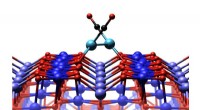
- Onderzoek naar mono-atomaire platinakatalysatoren
- Nieuw ontwerp van roterende vloeistofreactor lost problemen op met huidige reactoren

- Ontdekking van hoe amyloïden metaalionen binden werpt licht op de eiwitfunctie
- Onderzoekers benutten de kracht van carbenen om drugs gemakkelijker en veiliger te fabriceren
 Wat vormt zich als een warme luchtmassa botst met koude massa?
Wat vormt zich als een warme luchtmassa botst met koude massa?  Hoe je mensen hun belasting kunt laten betalen, blijkt uit onderzoek
Hoe je mensen hun belasting kunt laten betalen, blijkt uit onderzoek  Hoe gewas- en diersensoren de landbouw slimmer maken
Hoe gewas- en diersensoren de landbouw slimmer maken  Uit onderzoek blijkt dat goed luisteren kan helpen bij het bestrijden van klimaatverandering
Uit onderzoek blijkt dat goed luisteren kan helpen bij het bestrijden van klimaatverandering Zeewering bouwen is een kleine pleister op een gapende wond
Zeewering bouwen is een kleine pleister op een gapende wond Toestemmingsformulieren voor onderzoek:zijn ze in 25 jaar verbeterd?
Toestemmingsformulieren voor onderzoek:zijn ze in 25 jaar verbeterd?  Is Iron Pyrite Fools Gold Sedimentary Igneous of Metamorfe?
Is Iron Pyrite Fools Gold Sedimentary Igneous of Metamorfe?  Hoe het aantal overtollige elektronen te vinden
Hoe het aantal overtollige elektronen te vinden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


