
Wetenschap
Wat is de osmolariteit van aluminiumsulfaat van 10.00 gram opgelost in een waterige oplossing van 200 ml?
1. Bepaal het molecuulgewicht van aluminiumsulfaat (Al₂ (So₄) ₃)
* AL:26,98 g/mol (atoomgewicht) x 2 =53,96 g/mol
* S:32.06 g/mol x 3 =96.18 g/mol
* O:16.00 g/mol x 12 =192,00 g/mol
Totaal molecuulgewicht =53,96 + 96.18 + 192.00 = 342.14 g/mol
2. Bereken het aantal mol aluminiumsulfaat
* Mol =massa / molecuulgewicht
* Mol =10,00 g / 342.14 g / mol =0,0292 mol
3. Bepaal het aantal geproduceerde ionen per molecuul
* Aluminiumsulfaat dissocieert in 2 aluminiumionen (Al³⁺) en 3 sulfaationen (SO₄²⁻) voor een totaal van 5 ionen per molecuul.
4. Bereken de osmolariteit
* Osmolariteit =(aantal mol opgeloste stof x aantal ionen per molecuul) / oplossingvolume (in liters)
* Osmolariteit =(0,0292 mol x 5) / 0.200 l = 0.730 osm
Daarom is de osmolariteit van een aluminiumsulfaatoplossing van 10,00 g in 200 ml water 0,730 OSM.
 Lijst van herbivoren in de oceaan
Lijst van herbivoren in de oceaan Hoe helpt een ontwikkeling met een lage impact het regenwater te beheren?
Hoe helpt een ontwikkeling met een lage impact het regenwater te beheren?  Fatale horizon, gedreven door verzuring, sluit zich aan bij mariene organismen in de Zuidelijke Oceaan
Fatale horizon, gedreven door verzuring, sluit zich aan bij mariene organismen in de Zuidelijke Oceaan Hoe de Great Plains werden gevormd
Hoe de Great Plains werden gevormd Wat is het ecosysteem dat het koudste en verste noorden?
Wat is het ecosysteem dat het koudste en verste noorden?
Hoofdlijnen
- Indringende vraag:Wat gaat er verloren als een taal sterft?
- Hoe eieren hun vorm kregen:Aanpassingen voor de vlucht hebben mogelijk de variatie in eivorm bij vogels veroorzaakt
- Een besmettelijke ziekte is een die door wat veroorzaakt?
- Hoeveel organismen moeten er in een voedselketen zijn om cellulaire ademhaling uit te voeren?
- Wat is een homologe structuur?
- Geef twee redenen waarom het vrijwel onmogelijk is om veel menselijke eigenschappen te associëren met enkele genen
- Is lachen besmettelijk?
- Wat is een functie die automatisch de waarden in cellen direct boven of links van actieve cel toevoegt?
- Onderzoekers werpen licht op hoe een belangrijk ingrediënt voor leven zich in de ruimte kan vormen
- Vormveranderende materialen:licht gebruiken om macroscopische structuren te herschikken
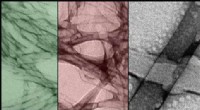
- Hoe met stikstof gedoteerde fluorescerende koolstofstippen bijdragen aan de strijd tegen ziekten
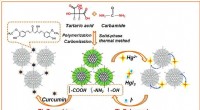
- Experiment verbetert voorspellingen van uraniumverspreiding

- Nieuwe methode zet methaan in aardgas bij kamertemperatuur om in methanol

- Licht vangen:hoe kobalt kan helpen zichtbaar licht te gebruiken om waterstofproductie uit water aan te drijven

 West-Afrika heeft een kleine wapencrisis – waarom sommige landen er beter mee om kunnen gaan dan andere
West-Afrika heeft een kleine wapencrisis – waarom sommige landen er beter mee om kunnen gaan dan andere  Spintronische neuronen unisono laten zingen
Spintronische neuronen unisono laten zingen Hoeveel valentie -elektronen heeft acetyleen?
Hoeveel valentie -elektronen heeft acetyleen?  Hoe komt de giraffe aan zijn lange nek? Aanwijzingen die nu worden onthuld door nieuwe genoomsequencing
Hoe komt de giraffe aan zijn lange nek? Aanwijzingen die nu worden onthuld door nieuwe genoomsequencing  Wat betreft de productie en de daaropvolgende fusie van gameten?
Wat betreft de productie en de daaropvolgende fusie van gameten?  Wetenschappers achter de ontdekking van zwaartekrachtsgolven winnen Nobelprijs voor natuurkunde 2017
Wetenschappers achter de ontdekking van zwaartekrachtsgolven winnen Nobelprijs voor natuurkunde 2017 Studie volgt DACA's voordelen, beperkingen voor immigranten zonder papieren
Studie volgt DACA's voordelen, beperkingen voor immigranten zonder papieren Een door licht geactiveerde afstandsbediening voor cellen
Een door licht geactiveerde afstandsbediening voor cellen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

