
Wetenschap
Hebben elementenverbindingen en mengsels het smeltende kookpunt vast?
elementen
* Vaste smelt- en kookpunten: Elementen hebben een specifiek, vast smelt- en kookpunt. Dit komt omdat ze uit slechts één type atoom bestaan.
* Voorbeeld: Water (H₂o) kookt altijd bij 100 ° C (212 ° F) bij standaarddruk.
Verbindingen
* Vaste smelt- en kookpunten: Net als elementen hebben verbindingen ook vaste smelt- en kookpunten. Dit komt omdat ze worden gevormd door een specifieke verhouding tussen verschillende elementen die aan elkaar zijn verbonden.
* Voorbeeld: Natriumchloride (NaCl) smelt altijd bij 801 ° C (1474 ° F).
mengsels
* Variabele smelten en kookpunten: Mengsels zijn combinaties van verschillende stoffen die niet chemisch zijn gebonden. Ze hebben een reeks smelt- en kookpunten, geen enkel vast punt.
* Voorbeeld: Zoutwater (zout opgelost in water) heeft een reeks kookpunten, afhankelijk van de zoutconcentratie.
Waarom de verschillen?
Het verschil ligt in de structuur en interacties tussen deeltjes:
* elementen en verbindingen: De sterke chemische bindingen binnen deze stoffen vereisen een specifieke hoeveelheid energie om te breken, wat leidt tot vast smelten en kookpunten.
* mengsels: De zwakkere intermoleculaire krachten (zoals waterstofbinding) tussen componenten in een mengsel kunnen worden verstoord bij variërende energieniveaus. Dit betekent dat het mengsel kan smelten of kookt over een reeks temperaturen.
Belangrijke opmerking:
* Onzuiverheden kunnen de smelt- en kookpunten van zowel elementen als verbindingen beïnvloeden. Het toevoegen van zout aan water verlaagt bijvoorbeeld zijn vriespunt.
Laat het me weten als je meer voorbeelden of uitleg wilt!
 Een Rubiks microfluïdische kubus
Een Rubiks microfluïdische kubus Kristaleilanden kunnen de tijd en kosten van wetenschappelijke experimenten halveren
Kristaleilanden kunnen de tijd en kosten van wetenschappelijke experimenten halveren Video:De chemie achter van kleur veranderende vogels
Video:De chemie achter van kleur veranderende vogels Wanneer natriumhydroxide in water oplost, is er sprake van een chemische verandering?
Wanneer natriumhydroxide in water oplost, is er sprake van een chemische verandering?  Hoeveel zwaveldioxide kan worden geproduceerd uit 64 kg zwavel?
Hoeveel zwaveldioxide kan worden geproduceerd uit 64 kg zwavel?
Hoofdlijnen
- Het Human Genome Project werd in 1988 begonnen door wetenschappers uit 13 naties als een wereldwijde inspanning om de sequencing van al het DNA -menselijk lichaam te begrijpen Wat is een potentieel wetenschappelijk voordeel?
- Wat zijn drie voorbeelden van virussen die het genetische materiaal RNA bevatten?
- Pas op voor de huisdieren bij het hanteren van de Halloween-snoepvangst
- De smalle bindende zak die zich uit het begin van de dikke darm uitstrekt, een overblijfsel orgaan zonder bekende functie?
- Omgevingsmuziek kan de psychische maalstroom kalmeren. Hier is hoe.
- Wetenschappers ontdekken pad naar verbeterde gerstkwaliteit
- Waarom zijn kalkoenen genetisch gemodificeerd?
- Hoe leeuwenbekken hun kleur behouden:bewegwijzeringstruc onthult evolutionair mechanisme
- Mensen gebruiken niet zoveel denkkracht als we graag denken
- Wat doet een chemische stof? Misvattingen over scheikunde aanpakken

- 'S Werelds eerste groene synthese van kunststoffen uit CO2
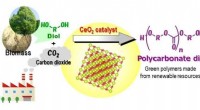
- Geïnspireerd door de natuur, het onderzoek om een nieuw dragend materiaal te ontwikkelen
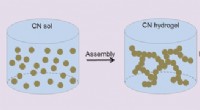
- Carbonitride-aerogels bemiddelen de fotokatalytische omzetting van water
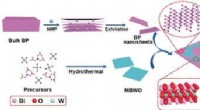
- Halfgeleiders bundelen krachten in fotokatalyse
 45.000 mariene soorten lopen gevaar. Wat is het meest kwetsbaar?
45.000 mariene soorten lopen gevaar. Wat is het meest kwetsbaar? Wat verklaart het beste hoe broeikasgassen de aarde verwarmen?
Wat verklaart het beste hoe broeikasgassen de aarde verwarmen?  Welk element is een niet -metaal en groen gas?
Welk element is een niet -metaal en groen gas?  Welke objecten werden geassocieerd met Apollo?
Welke objecten werden geassocieerd met Apollo?  Is deze vergelijking evenwichtig en in de laagste vorm 4NH3-2N2 6H2?
Is deze vergelijking evenwichtig en in de laagste vorm 4NH3-2N2 6H2?  Wat is de formule voor massa wanneer versnelling en kracht bekend zijn?
Wat is de formule voor massa wanneer versnelling en kracht bekend zijn?  De wetenschap vernieuwen:ruimte maken voor meer stemmen
De wetenschap vernieuwen:ruimte maken voor meer stemmen Wat is microtoxine?
Wat is microtoxine?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

