
Wetenschap
Hoe is het koken van water en koeldamp een omkeerbare reactie?
Het proces:
* koken: Wanneer je water verwarmt, krijgen de moleculen energie en beginnen ze sneller te bewegen. Uiteindelijk hebben ze voldoende energie om de krachten te overwinnen die ze als vloeistof bij elkaar houden, en ze ontsnappen in de lucht als waterdamp.
* koeldamp: Terwijl de waterdamp afkoelt, verliezen de moleculen energie. Ze vertragen en de aantrekkelijke krachten tussen hen worden sterker. Dit zorgt ervoor dat de moleculen samen klonten, waardoor vloeibare waterdruppeltjes worden gevormd.
Omkeerbare aard:
Dit proces is omkeerbaar omdat het in beide richtingen kan gebeuren:
* voorwaartse reactie: Vloeibaar water (h₂o) + warmte → waterdamp (h₂o)
* Omgekeerde reactie: Waterdamp (H₂o) + Koeling → vloeibaar water (H₂o)
evenwicht:
De snelheid van zowel de voorwaartse als de omgekeerde reacties hangt af van de temperatuur. Bij een specifieke temperatuur zal de kokensnelheid gelijk zijn aan de condensiesnelheid. Dit wordt evenwicht genoemd . Bij het evenwicht is er een constante uitwisseling van moleculen tussen de vloeistof- en dampfasen, maar de totale hoeveelheid water in elke fase blijft relatief stabiel.
factoren die het evenwicht beïnvloeden:
* Temperatuur: Hogere temperaturen geven de voorkeur aan de voorwaartse reactie (koken), terwijl lagere temperaturen de voorkeur geven aan de omgekeerde reactie (condensatie).
* Druk: Hogere druk maakt het moeilijker voor watermoleculen om te ontsnappen in de dampfase, zodat het de vloeibare toestand begunstigt. Lagere druk is de dampstaat begunstigt.
Samenvattend:
Het koken van water en koeling van damp zijn omkeerbare processen omdat ze in beide richtingen kunnen optreden. De snelheid van elke reactie wordt beïnvloed door temperatuur en druk, wat leidt tot een dynamisch evenwicht waarbij de hoeveelheid vloeistof en damp relatief constant blijft.
 Studie onderzoekt de impact van klimaatverandering op de Louisianas Houma-stam
Studie onderzoekt de impact van klimaatverandering op de Louisianas Houma-stam Wormen die mensen bijten
Wormen die mensen bijten Plastic fantastische of op de natuur gebaseerde speeltuinen:wat is het beste voor de ontwikkeling van kinderen?
Plastic fantastische of op de natuur gebaseerde speeltuinen:wat is het beste voor de ontwikkeling van kinderen?  Recordhitte in Californië is geen toevalstreffer, experts waarschuwen
Recordhitte in Californië is geen toevalstreffer, experts waarschuwen Wat betekent het woord cometitie als het in de ecologie wordt gebruikt?
Wat betekent het woord cometitie als het in de ecologie wordt gebruikt?
Hoofdlijnen
- Bacteriën reprodelen door welk proces?
- Indringende vraag:Moet de samenleving reproductieve technologieën reguleren?
- 2 Voorbeelden van Heterozygote eigenschappen
- Waarom zijn huidcellen en spieren anders?
- Contraststelling van reproductieve fenologische strategieën bij ontdekte gematigde houtsoorten
- Hoeveel weten wetenschappers over genen?
- Hoe brassinosteroïde-signalering ervoor zorgt dat wortels langer groeien bij stikstofgebrek
- Diverse landschappen in het hart van bijenbescherming
- Wat is de rol die van vitaal belang is van schimmels zoals Rhizopus in de natuur?
- Bruggen bouwen tussen atomen en hoogwaardige katalysatoren maken

- Wetenschappers ontwikkelen volledig door zonne-energie aangedreven autonome chemische minifabriek

- In kaart brengen en meten van eiwitten op de oppervlakken van endoplasmatisch reticulum (ER) in cellen

- Ontwikkeling van kern-schaal functionele composieten met uitstekende zelfsmerende eigenschappen
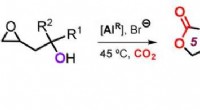
- Cascades met kooldioxide
 Hoe de winterzonnestilstand te berekenen Sun Angle
Hoe de winterzonnestilstand te berekenen Sun Angle Brexit kan de Britse autosector doen uitsterven:bedrijfslobby
Brexit kan de Britse autosector doen uitsterven:bedrijfslobby Een belangrijke aanvulling op de toolkit voor scheikundigen voor het bouwen van nieuwe moleculen
Een belangrijke aanvulling op de toolkit voor scheikundigen voor het bouwen van nieuwe moleculen Onderzoekers demonstreren het bestaan van een nieuwe vorm van elektronische materie
Onderzoekers demonstreren het bestaan van een nieuwe vorm van elektronische materie Hoe wordt thermische energie overgedragen op het oppervlak?
Hoe wordt thermische energie overgedragen op het oppervlak?  Curiosity rover bereikt zijn 3, 000ste dag op Mars
Curiosity rover bereikt zijn 3, 000ste dag op Mars Astronomen bevestigen dat de nabije ster een goed model is van ons vroege zonnestelsel
Astronomen bevestigen dat de nabije ster een goed model is van ons vroege zonnestelsel Luchtvervuiling fors gedaald tijdens lockdown
Luchtvervuiling fors gedaald tijdens lockdown
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

