
Wetenschap
Als 328 gram aluminiumhydroxide reageert met overtollig zoutzuur, hoeveel chloride kunnen er worden gevormd?
1. Schrijf de gebalanceerde chemische vergelijking:
AL (OH) ₃ (S) + 3HCl (AQ) → ALCL₃ (AQ) + 3H₂O (L)
2. Bereken de mol aluminiumhydroxide:
* Molaire massa van Al (OH) ₃ =78 g/mol
* Mol al (oh) ₃ =(328 g) / (78 g / mol) =4,21 mol
3. Bepaal de molverhouding van aluminiumhydroxide tot chloride -ionen:
* Uit de evenwichtige vergelijking produceert 1 mol AL (OH) ₃ 3 mol Cl⁻ -ionen.
4. Bereken de mol chloride -ionen:
* Mol CL⁻ =4,21 mol AL (OH) ₃ * (3 mol Cl⁻ / 1 mol AL (OH) ₃) =12,63 mol
5. Bereken het aantal chloride -ionen:
* Avogadro's nummer =6.022 x 10²³ ionen/mol
* Aantal Cl⁻ -ionen =12,63 mol * (6.022 x 10²³ ionen/mol) = 7,61 x 10²⁴ chloride -ionen
Daarom kan 328 gram aluminiumhydroxide reageren met overtollig zoutzuur vormen 7,61 x 10²⁴ chloride -ionen.
 Platina-molybdeencarbide gebruiken om waterstof katalytisch vrij te maken om een brandstofcel van stroom te voorzien
Platina-molybdeencarbide gebruiken om waterstof katalytisch vrij te maken om een brandstofcel van stroom te voorzien Welke van deze helpt wetenschappers nauwkeurige berekeningen te maken?
Welke van deze helpt wetenschappers nauwkeurige berekeningen te maken?  Welke zuren zitten er aan het glycerolmolecuul vast?
Welke zuren zitten er aan het glycerolmolecuul vast?  Welke metalloïde bevindt zich in de vierde periode en groep als koolstof?
Welke metalloïde bevindt zich in de vierde periode en groep als koolstof?  Lijmen en composietmaterialen gemaakt van Zwitserse boomschors
Lijmen en composietmaterialen gemaakt van Zwitserse boomschors
 NASA analyseert tropische storm Nate
NASA analyseert tropische storm Nate Inchworm patroon van Indonesische aardbeving breuk aangedreven seismische boom
Inchworm patroon van Indonesische aardbeving breuk aangedreven seismische boom Kwikbesmetting tiert welig in Brazilië Inheemse groep:studie
Kwikbesmetting tiert welig in Brazilië Inheemse groep:studie  Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?
Welk zeebioom wordt gekenmerkt door diepe waterdiepten die nooit zonlicht ontvangen?  Geen worm nodig:plastic walvis laat je naar afval vissen
Geen worm nodig:plastic walvis laat je naar afval vissen
Hoofdlijnen
- Wat is de klasse van hibiscusplanten?
- Welk element beschouwt het overwegen van levende organismen?
- Wat zijn plantesimals?
- Welk proces houdt de hoeveelheden moleculen binnen en buiten cellen in evenwicht?
- Wat is de naam voor een plantarts?
- Waarom is het nodig voor de cel om sommige cellulaire eiwitten af te breken?
- Mitochonadria worden gevonden in wat voor soort cellen?
- Enzymonderzoek onthult waarom sommige kankermedicijnen ernstige bijwerkingen veroorzaken
- Welke soorten cellen zijn omgeven door een celmembraan?
- Moleculen in collectieve extase

- Bacteriën misleiden om benzeen te hydroxyleren
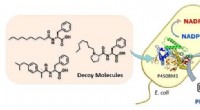
- Onderzoek onthult ligandherkenningsmechanisme van weesreceptor GPR119
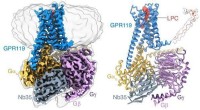
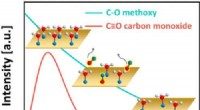
- Onverwacht gedrag gezien bij efficiënte katalysatoren voor schone energie
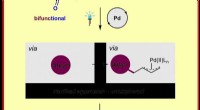
- Oude overgangsmetalen nieuwe trucjes leren:scheikundigen activeren palladiumkatalyse door licht
 Waarom worden de buitenplaneten de joviaanse planeet genoemd?
Waarom worden de buitenplaneten de joviaanse planeet genoemd?  Welke doelstelling van twee Apollo -missies was om de maan te draaien zonder te landen?
Welke doelstelling van twee Apollo -missies was om de maan te draaien zonder te landen?  Zal het einde van de COVID-19-pandemie een tweede Roaring 20s inluiden?
Zal het einde van de COVID-19-pandemie een tweede Roaring 20s inluiden? Natuurkundigen bedenken methode om te onthullen hoe licht materialen beïnvloedt
Natuurkundigen bedenken methode om te onthullen hoe licht materialen beïnvloedt Bandicoots overleefden eeuwen van veranderende klimaten,
Bandicoots overleefden eeuwen van veranderende klimaten,  Welk metaal vormt 3 ionen?
Welk metaal vormt 3 ionen?  Welke macromoleculen bestaat uit nucleïnezuren?
Welke macromoleculen bestaat uit nucleïnezuren?  Wetenschappers gebruiken chemische hulpmiddelen om kankerverwekkende eiwitten op te sporen
Wetenschappers gebruiken chemische hulpmiddelen om kankerverwekkende eiwitten op te sporen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

