
Wetenschap
Ammoniumsulfaat toegevoegd aan een hydroxide?
Dit is wat er gebeurt:
* ammoniumionen (NH₄⁺) reageren met hydroxide -ionen (OH⁻) om ammoniak (NH₃) en water (H₂o) te vormen:
NH₄⁺ + OH⁻ → NH₃ + H₂O
* sulfaationen (So₄²⁻) blijven in oplossing.
De algehele reactie kan worden weergegeven als:
(NH₄) ₂SO₄ + 2OH⁻ → 2NH₃ + 2H₂O + SO₄²⁻
belangrijke punten:
* De reactie is exotherme, wat betekent dat het warmte vrijgeeft.
* De geproduceerde ammoniak is een zwakke basis, dus de oplossing zal enigszins basic worden.
* Het gebruikte type hydroxide bepaalt de specifieke producten en de algehele reactie. Als u bijvoorbeeld natriumhydroxide (NaOH) gebruikt, zijn de producten natriumsulfaat (Na₂so₄) en ammoniak.
Voorbeelden:
* ammoniumsulfaat + kaliumhydroxide:
(NH₄) ₂SO₄ + 2KOH → 2NH₃ + 2H₂O + K₂SO₄
* ammoniumsulfaat + calciumhydroxide:
(NH₄) ₂SO₄ + CA (OH) ₂ → 2NH₃ + 2H₂O + CASO₄
Opmerking: De specifieke producten en reactieomstandigheden kunnen variëren, afhankelijk van de concentratie van de reactanten en de aanwezigheid van andere ionen in de oplossing.
 Hoe beïnvloeden de vijf factoren het klimaat?
Hoe beïnvloeden de vijf factoren het klimaat?  Pilootproject om te waarschuwen voor potentieel gevaarlijke meteotsunami-golven in de Grote Meren
Pilootproject om te waarschuwen voor potentieel gevaarlijke meteotsunami-golven in de Grote Meren Krachtige onderzeese aardbeving treft Zuid-Filippijnen geen schade
Krachtige onderzeese aardbeving treft Zuid-Filippijnen geen schade Veldsensor snel, identificeert nauwkeurig bodemproblemen
Veldsensor snel, identificeert nauwkeurig bodemproblemen Antarctisch schiereiland zal de komende twee decennia waarschijnlijk opwarmen
Antarctisch schiereiland zal de komende twee decennia waarschijnlijk opwarmen
Hoofdlijnen
- Is de Yucca -bloem een angiosperm?
- Wetenschappers publiceren het genoom van de waterbuffel
- Ondanks de wet stijgt het aantal doden door loodvergiftiging in New Hampshire
- Waarom groeien cellen op eiwitcoatedsteiger dan lege steiger?
- Welke carrières maken gebruik van anatomie?
- Welk bloedceltype wordt een polymorf genoemd?
- Gluconeogenese beschrijft de conversie van wat?
- Hoe komen ribosomen bij de ER van Nucleus?
- Wat zijn de 4 kenmerken die biologen gebruiken om levende dingen te herkennen?
- Een celdeurbel begrijpen
- Haar vindt nieuwe wortels als groeimedium voor stadslandbouw

- Radiofrequentie-energie wekt interesse in nanokatalysatoren bij lage temperatuur

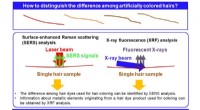
- Binnen een haarbreedte - forensische identificatie van enkel geverfde haarstreng nu mogelijk
- RNA-basisbouwsteen voor het eerst biokatalytisch geproduceerd
 Wat is een cyclisch patroon in de wetenschap?
Wat is een cyclisch patroon in de wetenschap?  Welk warmtedissipatiemechanisme gaat verloren wanneer de luchtvochtigheid 100 procent nadert?
Welk warmtedissipatiemechanisme gaat verloren wanneer de luchtvochtigheid 100 procent nadert?  Welk vliegtuig in ons zonnestelsel is bijna even groot als de aarde?
Welk vliegtuig in ons zonnestelsel is bijna even groot als de aarde?  Is de maan het enige dat de getijden beïnvloedt?
Is de maan het enige dat de getijden beïnvloedt?  Hoe gebruikt het lichaam organische moleculen?
Hoe gebruikt het lichaam organische moleculen?  Experimenten met warmtestraling
Experimenten met warmtestraling  Waarom is Bromine Polar?
Waarom is Bromine Polar?  Gravende zoogdieren graven voor de kost, maar hoe doen ze dat?
Gravende zoogdieren graven voor de kost, maar hoe doen ze dat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

