
Wetenschap
Een oplossing van ammoniumsulfaat wordt toegevoegd aan een kaliumhydroxide -oplossing?
1. Reactie:
(NH₄) ₂SO₄ (aq) + 2koh (aq) → k₂so₄ (aq) + 2nh₃ (g) + 2h₂o (l)
2. Verklaring:
* ammoniumsulfaat ((NH₄) ₂SO₄) is een oplosbaar zout dat dissocieert in oplossing in ammoniumionen (NH₄⁺) en sulfaationen (SO₄²⁻).
* kaliumhydroxide (KOH) is een sterke basis die dissocieert in oplossing in kaliumionen (k⁺) en hydroxide -ionen (OH⁻).
* De ammoniumionen (NH₄⁺) reageren met de hydroxide -ionen (OH⁻) Om ammoniakgas (NH₃) en water (H₂o) te vormen. Dit is een neutralisatiereactie.
* De kaliumionen (k⁺) en sulfaationen (So₄²⁻) Blijf in oplossing en vormt kaliumsulfaat (k₂so₄), die ook oplosbaar is.
3. Observaties:
* U zou waarschijnlijk bubbels in de oplossing zien. Dit komt door de afgifte van ammoniakgas.
* De oplossing kan ook iets warm worden Vanwege de exotherme reactie tussen ammoniumionen en hydroxide -ionen.
4. Over het algemeen produceert de reactie:
* kaliumsulfaat (k₂so₄) , die in de oplossing is opgelost.
* ammoniakgas (NH₃) , die in de lucht wordt vrijgegeven.
* water (h₂o) .
Belangrijke opmerking: Ammoniakgas heeft een scherpe geur en kan irritant zijn. Het is belangrijk om deze reactie uit te voeren in een goed geventileerd gebied.
 Hoeveel mol zijn er in 14,5 cm3 platina. De dichtheid platina 21.45 GCM3?
Hoeveel mol zijn er in 14,5 cm3 platina. De dichtheid platina 21.45 GCM3?  Welk ding neutraliseert zuren en basen?
Welk ding neutraliseert zuren en basen?  Wat gebeurt er als je verdunde hcl aan calciumchloride toevoegt?
Wat gebeurt er als je verdunde hcl aan calciumchloride toevoegt?  Onderzoek bevordert het begrip van hoe waterstofbrandstof wordt gemaakt
Onderzoek bevordert het begrip van hoe waterstofbrandstof wordt gemaakt  Een nieuw op polyethyleen-B4C gebaseerd beton voor afscherming
Een nieuw op polyethyleen-B4C gebaseerd beton voor afscherming
 De zeespiegel kan tegen 2100 met meer dan een meter stijgen als de emissiedoelstellingen niet worden gehaald
De zeespiegel kan tegen 2100 met meer dan een meter stijgen als de emissiedoelstellingen niet worden gehaald Ongebruikte bron, of de dreiging van broeikasgassen, gevonden onder de rifting-as voor de kust van Okinawa
Ongebruikte bron, of de dreiging van broeikasgassen, gevonden onder de rifting-as voor de kust van Okinawa Warmte voelen op het dak van de wereld
Warmte voelen op het dak van de wereld Nieuw onderzoek laat zien hoe hommels vogelnesten stelen
Nieuw onderzoek laat zien hoe hommels vogelnesten stelen  Strooizout is slecht voor het milieu, dus waarom blijven we het gebruiken?
Strooizout is slecht voor het milieu, dus waarom blijven we het gebruiken?
Hoofdlijnen
- Identificeer de organismen die ook cupdieren worden genoemd?
- Wat zijn de evolutiefasen?
- Welke cyclus produceert de meeste NADH?
- Waarom verwekken oudere mannetjesvogels meer onwettige kinderen?
- Heeft de pH van water invloed op groeireparaten?
- Welk deel van de haarschacht wordt corticale cellen gemaakt?
- Hoe gorillagebaren wijzen op de evolutie van de menselijke taal
- Fysische en chemische eigenschappen van lipiden
- Hoe maak je een MRI van je draak:onderzoekers ontwikkelen de eerste hersenatlas van de baardagaam
- Hoe zout uit water te halen:laat het zelf uitwerpen

- Synthese van opiumalkaloïden met behulp van elektrische stroom

- Het virtuele laboratorium van UNT-professoren kan de sleutel zijn tot het voorkomen van lekken van onderzeese oliepijpleidingen

- Gestroomlijnd proces opent de ontwikkeling van geneesmiddelen voor een nieuwe klasse steroïden
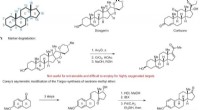
- Krachtige lasers voor kwetsbare kunstwerken

 Waarom het Duitse kolencompromis er niet in slaagde het debat te beëindigen?
Waarom het Duitse kolencompromis er niet in slaagde het debat te beëindigen? Welk natriumatoom of ion is groter met plus 1 lading?
Welk natriumatoom of ion is groter met plus 1 lading?  Californië zoekt naar manieren om invloed op het milieu te behouden
Californië zoekt naar manieren om invloed op het milieu te behouden Mammoettaak:de Russische familie op een opstandingszoektocht om de klimaatcrisis aan te pakken
Mammoettaak:de Russische familie op een opstandingszoektocht om de klimaatcrisis aan te pakken Hoe zijn arbeidskrachten en macht wiskundig met elkaar verbonden?
Hoe zijn arbeidskrachten en macht wiskundig met elkaar verbonden?  Hoeveel tijd om de zon te draaien voor elke planeet in uw zonnestelsel?
Hoeveel tijd om de zon te draaien voor elke planeet in uw zonnestelsel?  Klimaatomslagpunten kunnen onstuitbare veranderingen op de planeet tot gevolg hebben. Hoe dichtbij zijn ze?
Klimaatomslagpunten kunnen onstuitbare veranderingen op de planeet tot gevolg hebben. Hoe dichtbij zijn ze?  Welke organel kan suikerglucose en zuurstof omzetten in ATP energiemolecuul koolstofdioxide water?
Welke organel kan suikerglucose en zuurstof omzetten in ATP energiemolecuul koolstofdioxide water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

