
Wetenschap
Hoe schrijf je een evenwichtige vergelijking voor de reactie van zwavel met de volgende metalen om vaste stoffen te vormen die ionisch kunnen zijn wanneer anion S2 is?
Inzicht in de concepten
* ionische vaste stoffen: Deze verbindingen worden gevormd door de elektrostatische aantrekkingskracht tussen positief geladen metaalkationen (m⁺, m²⁺, enz.) En negatief geladen niet-metale anionen (in dit geval s²⁻).
* Balancing -vergelijkingen: Het doel is om ervoor te zorgen dat het aantal atomen van elk element hetzelfde is aan beide zijden van de vergelijking.
Algemene reactie:
Metaal (m) + zwavel (s) → metalen sulfide (MS)
Specifieke voorbeelden
1. Natrium (NA) en zwavel (S)
* onevenwichtig: Na + S → Na₂s
* uitgebalanceerd: 2na + S → Na₂s
2. magnesium (mg) en zwavel (s)
* onevenwichtig: Mg + s → mgs
* uitgebalanceerd: Mg + s → mgs
3. aluminium (AL) en zwavel (s)
* onevenwichtig: AL + S → Al₂s₃
* uitgebalanceerd: 2AL + 3S → Al₂s₃
4. IJzer (Fe) en zwavel (S)
* onevenwichtig: FE + S → FES
* uitgebalanceerd: FE + S → FES
Key Points
* Voorspellende ladingen: U moet de gemeenschappelijke ladingen van de metaalionen kennen om de juiste formule voor het metalen sulfide te bepalen. Natrium (NA) vormt bijvoorbeeld Na⁺, magnesium (mg) vormt mg²⁺ en aluminium (AL) vormt Al³⁺.
* Balancing op inspectie: Begin met het balanceren van de metaalatomen en evenwicht vervolgens de zwavelatomen. Mogelijk moet u de coëfficiënten voor de reactanten en producten aanpassen totdat de vergelijking in evenwicht is.
Laat het me weten als je wilt dat ik gebalanceerde vergelijkingen voor andere metalen schrijf!
 Oceaanbossen:hoe 'drijvende' mangroven een breed scala aan ecologische en sociale voordelen kunnen bieden
Oceaanbossen:hoe 'drijvende' mangroven een breed scala aan ecologische en sociale voordelen kunnen bieden  Mānoa:Zijn Hawaiiaanse koralen zich aan het aanpassen aan warmere temperaturen?
Mānoa:Zijn Hawaiiaanse koralen zich aan het aanpassen aan warmere temperaturen? Jamaica vernieuwt energiebeleid voor groen COVID-19-herstel
Jamaica vernieuwt energiebeleid voor groen COVID-19-herstel Dit schip hoopt als eerste onder de aardkorst te boren
Dit schip hoopt als eerste onder de aardkorst te boren  We moeten voorbij kortetermijnoplossingen voor droogte kijken en het land zelf verbeteren
We moeten voorbij kortetermijnoplossingen voor droogte kijken en het land zelf verbeteren
Hoofdlijnen
- Wat is vervangende klonen?
- Welk soort beschermend weefsel maakt de voering verschillende organen?
- Hoe virussen werken
- Een klein beetje spuug onthult veel over wat er in je mond leeft
- Hoe definiëren wetenschappers massa?
- Wat is de wetenschappelijke naam van Eugenia -fabriek?
- Central Dogma (Gene Expression): Definitie, Stappen, Verordening
- Welke microben leven in jouw darmen? Een microbioloog probeert testkits thuis uit om te zien wat ze onthullen over het microbioom
- Wat is het voordeel van aseksuele sporen?
- Voordeel:Water—Onderzoekers lossen belangrijke vraag op over titaniumoxide, water interacties

- Ferrofluide oppervlaktesimulaties gaan verder dan alleen de huid

- Een nieuw pad voor duurzame opconversie van fotonen met niet-edele metalen
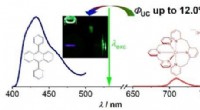
- Hernieuwbare hulpbron:om vitaal liponzuur te produceren, zwavel wordt gebruikt, dan bijgevuld
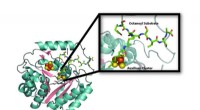
- Moleculaire chaperonne-interacties gevisualiseerd door middel van röntgenstructuuranalyse
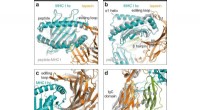
 Wat zijn enkele veel voorkomende wetenschapsonderwerpen?
Wat zijn enkele veel voorkomende wetenschapsonderwerpen?  Hoe kunnen we neutrino's gebruiken om donkere materie in de zon te onderzoeken?
Hoe kunnen we neutrino's gebruiken om donkere materie in de zon te onderzoeken?  Cellen in de ruimte
Cellen in de ruimte Nieuwe vroege signalen om de omvang van sterke aardbevingen te kwantificeren
Nieuwe vroege signalen om de omvang van sterke aardbevingen te kwantificeren Trump keurt Keystone XL-pijplijn goed fijne dag voor klussen
Trump keurt Keystone XL-pijplijn goed fijne dag voor klussen Elektriciteit uit schaliegas vs. steenkool:levenslange giftige uitstoot uit steenkool veel hoger
Elektriciteit uit schaliegas vs. steenkool:levenslange giftige uitstoot uit steenkool veel hoger Hoe circuleert koolstofdioxide tussen een boom en een vos?
Hoe circuleert koolstofdioxide tussen een boom en een vos?  Waarom hebben Cinder Kegels van korte duur?
Waarom hebben Cinder Kegels van korte duur?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

