
Wetenschap
Wat is de pH van dinatriumfosfaat?
Dit is waarom:
* Disatriumfosfaat (Na₂hpo₄) is een zout van een zwak zuur (H₂po₄⁻) en een sterke basis (NaOH). Dit betekent dat het hydrolyse ondergaat en reageert met water om een enigszins basisoplossing te produceren.
* De pH van de oplossing hangt af van de concentratie van disatriumfosfaat. Een meer geconcentreerde oplossing zal een hogere pH (meer basic) hebben in vergelijking met een verdunde oplossing.
Om de pH te berekenen, zou u het volgende moeten weten:
* concentratie van dinatriumfosfaat
* De evenwichtsconstante (kₐ) voor het zwakke zuur (h₂po₄⁻)
Hier is een vereenvoudigde uitleg over het bepalen van de pH:
1. Dissociatie van dinatriumfosfaat: Na₂hpo₄ dissocieert in water en brengt HPO₄²⁻ ionen vrij.
2. Hydrolyse: HPO₄²⁻ ionen reageren met water om H₂po₄⁻ en OH⁻ -ionen te vormen.
3. evenwicht: De evenwichtsconstante (kₐ) voor deze reactie bepaalt de relatieve concentraties van H₂PO₄⁻ en OH⁻ -ionen.
4. pH -berekening: Met behulp van de concentratie van OH⁻ -ionen kunt u de POH berekenen en van daaruit de pH met behulp van de vergelijking:pH + POH =14.
Als u de concentratie van dinatriumfosfaat heeft, kunt u de Henderson-Hasselbalch-vergelijking gebruiken om de pH te berekenen
Laat het me weten als je de concentratie van disatriumfosfaat hebt en ik kan je helpen de pH te berekenen.
 In het door orkaan getroffen Mexico Beach, een marathon opruiming begint
In het door orkaan getroffen Mexico Beach, een marathon opruiming begint Wat absorbeert de atmosfeer om de aarde te beschermen?
Wat absorbeert de atmosfeer om de aarde te beschermen?  Wereld zou 700 miljoen ton CO2 kunnen besparen als mensen meer zouden fietsen, blijkt uit onderzoek
Wereld zou 700 miljoen ton CO2 kunnen besparen als mensen meer zouden fietsen, blijkt uit onderzoek Europa moet meer doen tegen catastrofale klimaatrisico’s:EU
Europa moet meer doen tegen catastrofale klimaatrisico’s:EU  Wat is de toepassing van de wetenschap om mensen te helpen?
Wat is de toepassing van de wetenschap om mensen te helpen?
Hoofdlijnen
- Genomische analyse werpt licht op hoe zeegrassen de zee veroverden
- Waarschijnlijkheden in de genetica: waarom is het belangrijk?
- Wat is de studie van menselijke cellen van bemesting tot geboorte die wordt genoemd?
- Wat wordt voornamelijk aangetroffen in mitochondria lydsosoom ridosoom of Golgi -complexen van dierencellen?
- Welke structuur leidt lucht van de luchtpijp naar secundaire bronchiën?
- Is de celtheorie het gevolg van hypothese en observatie één persoon?
- Wetenschappers gebruiken hoogstwaarschijnlijk classificatiesystemen om organismen te scheiden in groepen op basis van overeenkomsten of verschillen in hun kenmerken omdat deze systemen?
- Homo sapiens faciliteerde de vestiging van Bonellis-adelaar in de Middellandse Zee 50.000 jaar geleden, zo blijkt uit onderzoek
- Wat is een testbaar idee of uitleg dat leidt tot wetenschappelijk onderzoek?
- Darmbacteriën vormen de sleutel tot het maken van universeel bloed
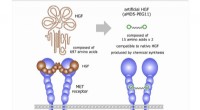
- Wetenschappers verkrijgen met succes een synthetische groeifactor die compatibel is met het inheemse eiwit
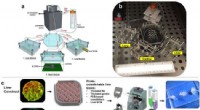
- Populair hulpmiddel voor het ontdekken van medicijnen is nu 10 keer sneller geworden

- Wetenschappers ontwikkelen body-on-a-chip-systeem om het testen van nieuwe medicijnen te versnellen
- Tethered chem combo's kunnen een revolutie teweegbrengen in kunstmatige fotosynthese

 Wat is de brekingswet van Snell?
Wat is de brekingswet van Snell?  Een Amerikaans bureau onderzoekt hoe uitbraken van algenbloei kunnen worden opgespoord
Een Amerikaans bureau onderzoekt hoe uitbraken van algenbloei kunnen worden opgespoord  Welke berg wordt het dak van de wereld genoemd?
Welke berg wordt het dak van de wereld genoemd?  Hoeveel waterstofatomen zitten er in de formule voor ammoniumsulfaat op?
Hoeveel waterstofatomen zitten er in de formule voor ammoniumsulfaat op?  Geen prijsstijging, maar nieuwe limieten op MoviePass-kortingsabonnement
Geen prijsstijging, maar nieuwe limieten op MoviePass-kortingsabonnement 8 Ontzagwekkende feiten over de Stille Oceaan
8 Ontzagwekkende feiten over de Stille Oceaan  Wat zijn heteroniemen en voorbeeld?
Wat zijn heteroniemen en voorbeeld?  Revolutionaire nieuwe oplossing voor halfgeleiders, Nanomaterialen
Revolutionaire nieuwe oplossing voor halfgeleiders, Nanomaterialen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

