
Wetenschap
Hoeveel mol NaCl worden gevormd uit de reactie tussen 1,4 HCl en 2,8 NaOH?
1. Schrijf de gebalanceerde chemische vergelijking:
HCl (aq) + NaOH (aq) → NaCl (aq) + h₂o (l)
2. Bepaal de beperkende reactant:
* mol HCl: We moeten aannemen dat je 1,4 mol HCl bedoelde. Als je 1,4 g bedoelde, moet je dat omzetten in mollen met behulp van de molaire massa van HCl.
* mol NaOH: 2.8 mol
Omdat de stoichiometrische verhouding tussen HCl en NaOH 1:1 is, is de beperkende reactant HCL omdat er minder mol ervan is.
3. Bereken de mol NaCl gevormd:
De stoichiometrische verhouding tussen HCl en NaCl is ook 1:1. Daarom zal het aantal gevormde mol NaCl gelijk zijn aan het aantal mol van de beperkende reactant (HCL).
Antwoord: 1.4 mol NaCl worden gevormd.
 GPM-radar ziet tornado die onweersbuien voortbrengt in Ohio Valley
GPM-radar ziet tornado die onweersbuien voortbrengt in Ohio Valley Vulkanische geo-engineering heeft mogelijk een klimaatcatastrofe veroorzaakt die de meeste diersoorten heeft gedood
Vulkanische geo-engineering heeft mogelijk een klimaatcatastrofe veroorzaakt die de meeste diersoorten heeft gedood Giftige planten van de Amazone
Giftige planten van de Amazone  Laagste Antarctische zee-ijs van juli op record:monitor
Laagste Antarctische zee-ijs van juli op record:monitor We spraken met overlevenden die zich voorbereiden op een ramp:dit is wat we hebben geleerd over het einde van de wereld
We spraken met overlevenden die zich voorbereiden op een ramp:dit is wat we hebben geleerd over het einde van de wereld
Hoofdlijnen
- Welk type cel moet een mutatie bevatten om haar nakomelingen van de vrouw te krijgen?
- Wat zijn de functies van zetmeel in plantencellen?
- Hoe ondersteunt genetische variatie de natuurlijke selectie?
- Wie was de 2 wetenschapper die structuur van dubbele helix -DNA ontwikkelde?
- Hoe celstructuren te identificeren
- Scheve vissen laten zien dat symmetrie slechts oppervlakkig is
- Politieke instabiliteit en zwak bestuur leiden tot verlies van soorten, studie vondsten
- Hoe eieren hun vorm kregen:Aanpassingen voor de vlucht hebben mogelijk de variatie in eivorm bij vogels veroorzaakt
- Inwoners van Illinois moedigden aan om de eieren van invasieve insecten te vernietigen om de verspreiding te vertragen
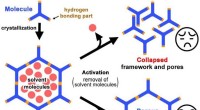
- Poreuze materialen werpen licht op milieuzuivering
- Titan-supercomputer analyseert bacterieel fotosynthesesysteem
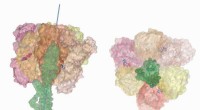
- Nieuwe lipidevormatlas is de sleutel tot vroege ziektedetectie

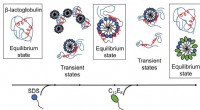
- Met zeep betrapt:begrijpen hoe zeepmoleculen eiwitten helpen om in en uit vorm te komen
- Koelere katalysatoren:schonere lucht voor iedereen

 Nieuwe studie om eerst te voorspellen welke olie- en gasbronnen methaan lekken
Nieuwe studie om eerst te voorspellen welke olie- en gasbronnen methaan lekken Het unieke seksuele karakter van Sohos moet behouden blijven, zeggen onderzoekers
Het unieke seksuele karakter van Sohos moet behouden blijven, zeggen onderzoekers Verbergen alle planeten zich rond de zon van west naar oost?
Verbergen alle planeten zich rond de zon van west naar oost?  Probe maakt tumoronderzoek mogelijk met behulp van complementaire beeldvormingstechnieken
Probe maakt tumoronderzoek mogelijk met behulp van complementaire beeldvormingstechnieken NASA richt zich opnieuw op de lancering van Boeings Starliner op 1 juni
NASA richt zich opnieuw op de lancering van Boeings Starliner op 1 juni  Nieuwe studie vindt dat studenten met een laag inkomen niet profiteren van privéonderwijs
Nieuwe studie vindt dat studenten met een laag inkomen niet profiteren van privéonderwijs Tempo van veranderingen in de Beringzee doet wetenschappers schrikken
Tempo van veranderingen in de Beringzee doet wetenschappers schrikken Hoeveel moleculen zijn er aanwezig in 42,0 g Cl2?
Hoeveel moleculen zijn er aanwezig in 42,0 g Cl2?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

