
Wetenschap
Wat is een groep verbindingen die ionen vrijgeven wanneer opgelost in water dat wordt genoemd?
Dit is waarom:
* elektrolyten zijn stoffen die elektriciteit leiden wanneer opgelost in water. Deze geleidbaarheid is te wijten aan de aanwezigheid van vrije ionen, die geladen deeltjes zijn die vrij kunnen bewegen.
* Wanneer een elektrolyt oplost in water, breekt deze af in zijn samenstellende ionen. Tafelzout (NaCl) lost bijvoorbeeld op in water om natriumionen (Na+) en chloride-ionen (Cl-) te vormen.
* De aanwezigheid van deze vrije ionen stelt de oplossing in staat om elektriciteit te leiden.
Voorbeelden van elektrolyten:
* Zouten (zoals natriumchloride, kaliumchloride)
* Zuren (zoals zoutzuur, zwavelzuur)
* Bases (zoals natriumhydroxide, kaliumhydroxide)
Belangrijke opmerking: Niet alle verbindingen zijn elektrolyten. Sommige verbindingen, zoals suiker (sucrose), dissociëren niet in ionen wanneer opgelost in water en worden daarom niet -elektrolyten genoemd .
 Rioolschat:ingenieurs onthullen hoe ze processen kunnen optimaliseren voor het omzetten van zwavel in afvalwater in waardevolle materialen
Rioolschat:ingenieurs onthullen hoe ze processen kunnen optimaliseren voor het omzetten van zwavel in afvalwater in waardevolle materialen Welk belangrijke organische molecule vormt geen macromolecuul?
Welk belangrijke organische molecule vormt geen macromolecuul?  Wat is de verandering van vloeistof naar gas?
Wat is de verandering van vloeistof naar gas?  Hebben vaste stoffen een hoog of laag smeltpunt?
Hebben vaste stoffen een hoog of laag smeltpunt?  Kent iemand de formule voor endotherme reactie en exotherme reactie?
Kent iemand de formule voor endotherme reactie en exotherme reactie?
 Republikeinen en Democraten zijn het eens over klimaatverandering - ze beseffen het gewoon niet
Republikeinen en Democraten zijn het eens over klimaatverandering - ze beseffen het gewoon niet Orkaan Sally wint aan kracht naarmate het zuiden van de VS nadert
Orkaan Sally wint aan kracht naarmate het zuiden van de VS nadert Acacia bushlands voorkomen klimaatopwarming in Oost-Afrika
Acacia bushlands voorkomen klimaatopwarming in Oost-Afrika COVID-19 dwingt nieuwe voedselveiligheidsnormen in Azië af
COVID-19 dwingt nieuwe voedselveiligheidsnormen in Azië af Studie vindt dat giftig kwik zich ophoopt in de Arctische toendra
Studie vindt dat giftig kwik zich ophoopt in de Arctische toendra
Hoofdlijnen
- Waarom zijn neuronen en spiercellen rijk aan mitochondriën?
- In welke biomen leven konijnen?
- Organismen die lichtenergie van de zon opvangen en in voedsel omzetten, worden?
- Wie zijn de verschillende biologen en hun bijdragen aan de ontwikkeling van de biologische biotechnologie?
- Wat is de rol van DNA bij het bepalen van en organismen eigenschappen?
- Monarchvlinders getagd met stickers in de tuin van Chicago terwijl ze naar het zuiden trekken
- Wat is het LRAGE -ogran in uw lichaam?
- Onderzoekers hebben voor het eerst de scharniermorfologie van het klinkmechanisme van de klikkever aangetoond
- Hoe werkt het cytoplasma eruit?
- Wetenschappers onthullen potentiële afhankelijkheid van elektroreductie van stikstofmonoxide tot ammoniak
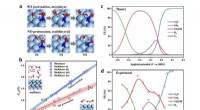
- Suikers synthetiseren:scheikundigen ontwikkelen methode om de opbouw van koolhydraten te vereenvoudigen
- Synthetische tweezijdige gekko's kunnen onderwaterrobotica mogelijk maken
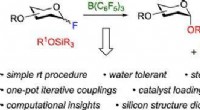
- Chemische synthese met kunstmatige intelligentie:onderzoekers ontwikkelen nieuwe computermethode
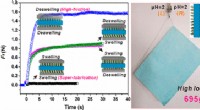
- Op katoen gebaseerde hybride biobrandstofcel kan implanteerbare medische apparaten van stroom voorzien

 Wat zijn de belangrijkste verschillen tussen plantaardige en dierlijke cellen?
Wat zijn de belangrijkste verschillen tussen plantaardige en dierlijke cellen?  Voordelige lentetruffels of voortreffelijke Piemontese truffels? Nieuwe analysemethode kan voedselfraude opsporen
Voordelige lentetruffels of voortreffelijke Piemontese truffels? Nieuwe analysemethode kan voedselfraude opsporen  Welke maand volgt de zon het langste pad over de lucht?
Welke maand volgt de zon het langste pad over de lucht?  Foto-geïnitieerde ladingsscheiding in nanobiohybride complex
Foto-geïnitieerde ladingsscheiding in nanobiohybride complex Wat zijn vier verschillende verbindingen die kalium bevatten?
Wat zijn vier verschillende verbindingen die kalium bevatten?  Wat is Plancks constant,
Wat is Plancks constant,  De methode voor het toedienen van medicijnen is veelbelovend voor het bestrijden van gewasparasieten
De methode voor het toedienen van medicijnen is veelbelovend voor het bestrijden van gewasparasieten Nieuwsmedia lobbyt Merkel, Macron over hervorming van het auteursrecht
Nieuwsmedia lobbyt Merkel, Macron over hervorming van het auteursrecht
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

