
Wetenschap
Wat is de theoretische opbrengst van bromo benzeen in deze reactie wanneer 35,0 g reageert met 75,8 broom?
1. Schrijf de gebalanceerde chemische vergelijking:
De reactie van benzeen met broom (in aanwezigheid van een katalysator zoals februari) is een elektrofiele aromatische substitutiereactie. De evenwichtige vergelijking is:
C₆h₆ + br₂ → c₆h₅br + hbr
2. Bepaal de beperkende reactant:
* Bereken de mol van elke reactant:
* Mol benzeen (c₆h₆) =(35,0 g) / (78,11 g / mol) =0,448 mol
* Mol bromine (br₂) =(75,8 g) / (159,80 g / mol) =0,474 mol
* Vergelijk de molverhouding van reactanten met de stoichiometrische verhouding: De evenwichtige vergelijking toont een 1:1 molverhouding tussen benzeen en broom. Omdat we iets meer mol broom hebben dan benzeen, is benzeen de beperkende reactant .
3. Bereken de theoretische opbrengst van bromobenzeen (c₆h₅br):
* Gebruik de molverhouding van de gebalanceerde vergelijking: 1 mol benzeen produceert 1 mol bromobenzeen.
* Molden benzeen omzetten in mol bromobenzeen:
* Mol bromobenzeen =0,448 mol benzeen
* Moles van bromobenzeen omzetten in gram:
* Theoretische opbrengst van bromobenzeen =(0.448 mol) * (157.01 g/mol) = 70,4 g
Daarom is de theoretische opbrengst van bromobenzeen in deze reactie 70,4 gram.
 Wat veroorzaakt aardbevingen in het noordoosten, zoals de magnitude 4,8 die New Jersey deed schudden? Een geowetenschapper legt het uit
Wat veroorzaakt aardbevingen in het noordoosten, zoals de magnitude 4,8 die New Jersey deed schudden? Een geowetenschapper legt het uit  Onderzoekers ontwikkelen kader voor mitigatie van klimaatverandering in mijnbouw
Onderzoekers ontwikkelen kader voor mitigatie van klimaatverandering in mijnbouw Sterke aardbeving doodt 5 doden, tientallen gewonden in het noorden van de Filipijnen
Sterke aardbeving doodt 5 doden, tientallen gewonden in het noorden van de Filipijnen Hoe de afstand van een stad te vinden van de evenaar
Hoe de afstand van een stad te vinden van de evenaar Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Studie van boomringen biedt meer bewijs van poolwaartse migratie van tropische stormen
Hoofdlijnen
- Hoe reproduceert een huisvlieg zich?
- Hoe eiwitaggregatie plaatsvindt in cellen
- Fruitvliegjesplaag ontmoet zijn evolutionaire match in sluipwesp
- Wil een mutatie de evolutie beïnvloeden, dan moet deze plaatsvinden in?
- Wat is een medische plant?
- Wie zijn de Filipijnse wetenschapper en hun kenmerken?
- Wat zijn de twee verschillende gezichten van fosfolipiden die een oppervlaktemembraan vormen, een cel?
- Pigment of bacteriën? Onderzoekers onderzoeken het idee van 'kleur' in fossiele veren opnieuw
- Wat is de reden dat plantencellen een extra dikke buitenste bedekking hebben en die worden genoemd?
- Onderzoekers vinden een verrassing net onder het oppervlak in een koolstofdioxide-experiment
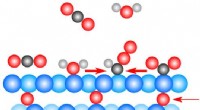
- Een veelzijdige, geïntegreerde workflow voor interactie proteomics
- Nieuw materiaal kan waterstof maken uit zout en vervuild water

- Hoe gebogen oppervlakken in alle vormen uitzetten en samentrekken?

- Een nieuwe methode om spiegels van variabele grootte af te drukken met een reflectie van meer dan 99%

 Groene groepen zetten vraagtekens bij plasticopruimingsplan van grote industrie
Groene groepen zetten vraagtekens bij plasticopruimingsplan van grote industrie Schone energie van lokale producenten
Schone energie van lokale producenten Zonnestelsel verwierf de huidige configuratie niet lang na zijn vorming
Zonnestelsel verwierf de huidige configuratie niet lang na zijn vorming Bezorgd over klimaatverandering? Plant een overwinningstuin
Bezorgd over klimaatverandering? Plant een overwinningstuin Wat voor soort suiker is ribose?
Wat voor soort suiker is ribose?  Welk dia -organisme in mitose plantencel?
Welk dia -organisme in mitose plantencel?  Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen
Eetbare, fluorescerende zijden tags kunnen nepmedicijnen opsporen Waar ging de eerste ruimtesonde heen?
Waar ging de eerste ruimtesonde heen?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

