
Wetenschap
Wat is de reactie tussen NH4NO3 en KCL?
Dit is waarom:
* Oplosbaarheid: Zowel ammoniumnitraat als kaliumchloride zijn zeer oplosbaar in water. Dit betekent dat ze zich in hun ionen zullen dissociëren wanneer ze opgelost zijn:
* NH₄no₃ (aq) → nH₄⁺ (aq) + no₃⁻ (aq)
* KCL (aq) → k⁺ (aq) + cl⁻ (aq)
* Geen drijvende kracht: Er is geen drijvende kracht voor een reactie.
* Geen neerslagvorming: De mogelijke producten, kaliumnitraat (kno₃) en ammoniumchloride (NH₄CL), zijn ook sterk oplosbaar in water, dus er zal geen neerslag vormen.
* Geen gasvorming: Er worden geen gassen geproduceerd.
* Geen significante warmteverandering: De reactie is niet exotherme of endotherm genoeg om een reactie aan te sturen.
Daarom, wanneer NH₄NO₃ en KCL in oplossing worden gemengd, bestaan ze eenvoudigweg naast hun respectieve ionen.
 Wat is het proces waarbij moleculen zich gelijkmatig door de kamer verspreiden?
Wat is het proces waarbij moleculen zich gelijkmatig door de kamer verspreiden?  Enzymsysteem voor de waterstofindustrie
Enzymsysteem voor de waterstofindustrie Raamwerkdiversiteit van koolstofnitrides biedt een rijk platform voor katalyse met één atoom
Raamwerkdiversiteit van koolstofnitrides biedt een rijk platform voor katalyse met één atoom De stijfste poreuze lichtgewicht materialen ooit
De stijfste poreuze lichtgewicht materialen ooit Welk effect heeft de overtuiging dat de meeste materie mengsels was op de chemie?
Welk effect heeft de overtuiging dat de meeste materie mengsels was op de chemie?
 Typen bedreigde regenwoudplanten
Typen bedreigde regenwoudplanten Hoe betrouwbaar zijn schildpadden voor het meten van afval in de oceaan en de gezondheid van de zee?
Hoe betrouwbaar zijn schildpadden voor het meten van afval in de oceaan en de gezondheid van de zee? Hoe vogels met verschillende veren samenkomen
Hoe vogels met verschillende veren samenkomen  Acht Colorado-meren verdacht van giftige algenbloei:waarom het erger wordt
Acht Colorado-meren verdacht van giftige algenbloei:waarom het erger wordt  Een vulkaan op IJsland barst voor de vierde keer in drie maanden tijd uit, waardoor lavapluimen de lucht in worden gestuurd
Een vulkaan op IJsland barst voor de vierde keer in drie maanden tijd uit, waardoor lavapluimen de lucht in worden gestuurd
Hoofdlijnen
- Begrijpen hoe bacteriën voedsel zoeken en ernaar toe bewegen
- Wetenschappers ontdekken hoe vampiervleermuizen de smaak voor bloed kregen
- Gepantserde worm onthult de voorouders van drie grote diergroepen
- Waar vindt anaërobe ademhaling plaats?
- Waarom heeft het menselijk lichaam geen eiwitten opslag?
- Studie onderzoekt hoe de ruimtelijke verdeling van cellen in micro-omgevingen kan worden gecontroleerd
- Hoe een eiwitcomponent van nucleaire poriecomplexen de ontwikkeling van bloedcellen reguleert, draagt bij aan myeloïde aandoeningen
- Wat is een Micel in Biochemie?
- Hoe lang duren orchideeënbloeien? Tips voor het kweken van orchideeën
- Hoe klimaatveranderende koolstofdioxide om te zetten in plastic en andere producten?
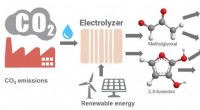
- Spinzijde gemaakt door fotosynthetische bacteriën

- Een lasertechniek blijkt effectief om materiaal terug te winnen dat is ontworpen om industriële producten te beschermen

- Hydrogenering zonder waterstof:efficiënte katalyse in een stabiele emulsiegel
- Geitenmelkkefir is bewezen goed voor je gezondheid

 Krachtige tyfoon raast over Filipijnen kerst bederven (update)
Krachtige tyfoon raast over Filipijnen kerst bederven (update) In Portugal, kurken nog top schroefdoppen
In Portugal, kurken nog top schroefdoppen Nieuwe microscopen ontrafelen de mysteries van hersenorganisatie
Nieuwe microscopen ontrafelen de mysteries van hersenorganisatie Nieuwe methode benchmarkt organische gemengde geleiders
Nieuwe methode benchmarkt organische gemengde geleiders Hoe wordt één cel twee in het lichaam?
Hoe wordt één cel twee in het lichaam?  Machine learning helpt bij het verbeteren van fotonische toepassingen
Machine learning helpt bij het verbeteren van fotonische toepassingen Wanneer landden astronauten op de maan?
Wanneer landden astronauten op de maan?  Wat is de aardoppervlak veel bedekt?
Wat is de aardoppervlak veel bedekt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

