
Wetenschap
Wat voor soort kristallen absorberen waterdamp uit de lucht?
Hier zijn enkele voorbeelden van hygroscopische kristallen:
* Natriumchloride (NaCl): Tafelzout is enigszins hygroscopisch, wat betekent dat het watermoleculen uit de lucht aantrekt, vooral in vochtige omgevingen. Daarom kan zout na verloop van tijd klonterig worden.
* calciumchloride (CACL2): Dit is een zeer hygroscopisch zout dat vaak wordt gebruikt als droogmiddel (droogmiddel). Het absorbeert water uit de lucht, waardoor het nuttig is om ruimtes of materialen uit te drogen.
* kaliumhydroxide (KOH): Dit is een sterke basis die erg hygroscopisch is en zelfs voldoende water kan absorberen om zichzelf op te lossen.
* magnesiumsulfaat (MgSO4): Deze verbinding, vaak aangetroffen in Epsom -zouten, is hygroscopisch en wordt vaak gebruikt in droogtoepassingen.
Belangrijke opmerking: Hoewel deze kristallen watermoleculen aantrekken en vasthouden, "absorberen" ze ze niet letterlijk op dezelfde manier als een spons. De watermoleculen zijn meer aangetrokken en gehouden op het oppervlak van het kristal.
Verder lezen:
* hygroscopisch: [https://en.wikipedia.org/wiki/hygroscopy buch(https://en.wikipedia.org/wiki/hygroscopy)
* Desicants: [https://en.wikipedia.org/wiki/desiccant buch(https://en.wikipedia.org/wiki/desiccant)
 Waar kwam het uranium dat werd gebruikt in de atoombom van Hiroshima vandaan?
Waar kwam het uranium dat werd gebruikt in de atoombom van Hiroshima vandaan?  Hoe werken luchtwassers?
Hoe werken luchtwassers?  Wanneer oxaloactinezuur en acetyl-CoA combineren welk product is gemaakt?
Wanneer oxaloactinezuur en acetyl-CoA combineren welk product is gemaakt?  Nieuw onderzoek naar een recent ontdekt chlorofylmolecuul kan de sleutel zijn tot betere zonnecellen
Nieuw onderzoek naar een recent ontdekt chlorofylmolecuul kan de sleutel zijn tot betere zonnecellen Wat is de oppervlaktetemperatuur van Vissen?
Wat is de oppervlaktetemperatuur van Vissen?
Hoofdlijnen
- Celbioloog legt uit hoe RNA-virussen zichzelf kopiëren
- Welke organismen eten nereis?
- Welk organisme kan de vorm veranderen?
- Ontdekking van een mechanisme om de richting van collectieve celmigratie te bepalen
- Een beetje stress is goed voor de gezondheid van de cellen en een lang leven
- Hoe vormen zich tetraploïden en aneuploïden?
- Wetenschappers leren meer over hoe motoren de wegen van onze cellen manoeuvreren
- Genoomsequencing onthult uitgebreide inteelt bij Scandinavische wolven
- Wat zijn het mannelijke en vrouwelijke deel van een plant?
- Studie beschrijft hoe externe krachten de herschikking van individuele deeltjes in ongeordende vaste stoffen aandrijven

- Wetenschappers bouwen allereerste synthetisch DNA-achtig polymeer
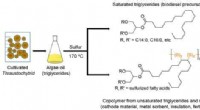
- Eenvoudige methode om hoogwaardige bioactieve stoffen te extraheren uit eencellige algenolie
- Efficiënte katalysator op basis van titanium gebruikt om PEF te produceren, biobased alternatief voor PET

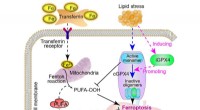
- Gericht op een nieuwe induceerbare isovorm voor de behandeling van metabole gerelateerde leververvetting
 Nieuwe benadering voor röntgenbeeldvorming kan de resolutie op nanoschaal verhogen voor geavanceerde upgrade van fotonenbronnen
Nieuwe benadering voor röntgenbeeldvorming kan de resolutie op nanoschaal verhogen voor geavanceerde upgrade van fotonenbronnen Wat is de naam van asteroïde die zijn eigen maan had?
Wat is de naam van asteroïde die zijn eigen maan had?  Welke hulpbron kun je gebruiken om energie te produceren?
Welke hulpbron kun je gebruiken om energie te produceren?  De wijnindustrie van de wereld past zich aan de klimaatverandering aan
De wijnindustrie van de wereld past zich aan de klimaatverandering aan Het toevoegen van menselijke aanraking aan onpraktische chatbots kan leiden tot een grotere teleurstelling
Het toevoegen van menselijke aanraking aan onpraktische chatbots kan leiden tot een grotere teleurstelling Wereldrecord gebroken voor dunste röntgendetector ooit gemaakt
Wereldrecord gebroken voor dunste röntgendetector ooit gemaakt  Hoeveel atomen heeft natriumhydroxide?
Hoeveel atomen heeft natriumhydroxide?  Hoe bakbananen en koolstofnanobuisjes auto's kunnen verbeteren
Hoe bakbananen en koolstofnanobuisjes auto's kunnen verbeteren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

