
Wetenschap
Het lijnemissiespectrum van een atoom wordt veroorzaakt door de vrijgegeven energieën wanneer elektronen?
Hier is een uitsplitsing:
* elektronen in atomen: Elektronen in atomen bestaan in specifieke energieniveaus. Deze niveaus zijn gekwantiseerd, wat betekent dat elektronen alleen bepaalde afzonderlijke energiewaarden kunnen bezetten.
* opgewonden toestand: Wanneer een elektron energie absorbeert (uit warmte, licht of andere bronnen), springt het naar een hoger energieniveau en wordt het "opgewonden".
* ontspanning en emissie: De opgewonden toestand is onstabiel. Het elektron zal uiteindelijk terugkeren naar een lager energieniveau, waardoor de geabsorbeerde energie als een foton van licht wordt vrijgeeft.
* Lijnspectrum: Omdat de energieniveaus worden gekwantiseerd, zijn de energieverschillen tussen hen specifiek. Dit resulteert in fotonen van specifieke golflengten die worden uitgestoten, waardoor de verschillende lijnen in het emissiespectrum worden ontstaan.
Key Takeaway: Lijnemissiespectra zijn een unieke vingerafdruk van een element, waarbij de specifieke overgangen van het energieniveau binnen zijn atomen worden onthuld.
 Handel en migratie zullen van invloed zijn op de manier waarop staten zich aanpassen aan de klimaatverandering
Handel en migratie zullen van invloed zijn op de manier waarop staten zich aanpassen aan de klimaatverandering  We hebben veel geleerd sinds de grootste aardbeving in Zuid-Afrika, 50 jaar geleden
We hebben veel geleerd sinds de grootste aardbeving in Zuid-Afrika, 50 jaar geleden Extreme overstromingen treffen Amerikaanse steden bijna dagelijks tegen 2100
Extreme overstromingen treffen Amerikaanse steden bijna dagelijks tegen 2100 Welke twee grote nieuwigheden maakten de eerste kolonisatie van terrestrische habitats door planten mogelijk?
Welke twee grote nieuwigheden maakten de eerste kolonisatie van terrestrische habitats door planten mogelijk?  Wanneer een Hummingbird Feeder in Austin, Texas
Wanneer een Hummingbird Feeder in Austin, Texas
Hoofdlijnen
- Diffusie: wat is het? & Hoe gebeurt het?
- Welk type levenscyclus bestaat er waarin de haploïde vorm altijd als mensen eencellig is?
- De Atlantische steuren verblijven
- Onderzoeksteam ontwikkelt universele en nauwkeurige methode om te berekenen hoe eiwitten interageren met medicijnen
- Beschrijf de anatomische positie en waarom is deze kennis belangrijk?
- Wat zijn variaties in specifieke nucleotiden die gekoppeld zijn aan menselijke ziekten?
- Hoe bewegen onze cellen? Vloeistofdruppels zouden dit kunnen verklaren
- Wat is de wetenschappelijke verklaring voor seks bij mensen?
- Nieuwe inzichten in evolutie:waarom genen lijken te bewegen
- Een nieuwe samengestelde brandstof maken voor snelle reactoren van de volgende generatie
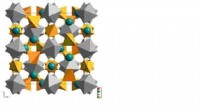
- Calculus III voor cellen

- Vergroening van biomaterialen en steigers die worden gebruikt in regeneratieve geneeskunde

- Algoritme identificeert optimale paren voor het samenstellen van metaal-organische raamwerken
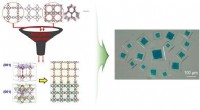
- Nieuwe techniek maakt de weg vrij voor perfecte perovskieten

 Angstige conservatieven en boze liberalen verwerken politieke informatie anders
Angstige conservatieven en boze liberalen verwerken politieke informatie anders Expertblog:hoe om te gaan met nepnieuws en verkeerde informatie
Expertblog:hoe om te gaan met nepnieuws en verkeerde informatie Hoe AI het beter doet dan spreadsheets bij het modelleren van toekomstige volumes voor stadsafvalbeheer
Hoe AI het beter doet dan spreadsheets bij het modelleren van toekomstige volumes voor stadsafvalbeheer Is de combinatie van zuurstof en waterstof om water te vormen een fysische of chemische verandering?
Is de combinatie van zuurstof en waterstof om water te vormen een fysische of chemische verandering?  Veren, cognitie en mondiaal consumentisme in het koloniale Amazonegebied
Veren, cognitie en mondiaal consumentisme in het koloniale Amazonegebied  Wat is de naam van een plek waar mensen telescopen en andere wetenschappelijke apparatuur gebruiken?
Wat is de naam van een plek waar mensen telescopen en andere wetenschappelijke apparatuur gebruiken?  Astronomen vinden het eerste sterke bewijs dat er een neutronenster overblijft van een exploderende ster
Astronomen vinden het eerste sterke bewijs dat er een neutronenster overblijft van een exploderende ster  Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
Mechanisme van remming van schorpioentoxine van K+-kanaal opgehelderd met behulp van snelle AFM
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

